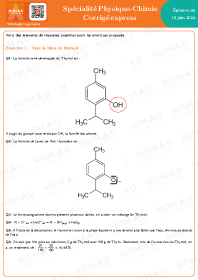
Titrage conductimétriques
Un titrage conductimétrique ne peut être effectué que si la réaction du titrage fait intervenir des ions.

Détermination du point d'équivalence
Dans tous les cas, ces deux droites se coupent en un point correspondant au changement de pente de la courbe. Ce point représente l'équivalence. On lit alors son abscisse pour obtenir le volume équivalent $\rm V_E$.
Loi de Kohlrausch
$\scriptstyle\color{limegreen}{\boxed{\color{black}{\scriptstyle\sigma = \sum\limits_i^n\scriptstyle\lambda_i \times [\mathrm X_i]}}}\color{balck}{\scriptstyle\left| \begin{array}{lll}\scriptstyle\sigma : \text{ conductivité en }\rm S.m^{-1}\\
\scriptstyle\lambda : \text{ conductivité ionique molaire } \rm S.m^2.mol^{-1}\\
\scriptstyle\rm [X] : \text{ concentration ionique en } \color{limegreen}{mol.m^{-3}}\\
\color{limegreen}{\scriptstyle\rm(attention)}\end{array}\right.}$

Évolution des concentrations ioniques
$\color{black}{\rm V_B}$ |
$\color{black}{\rm [H_3O^+]}$ |
$\color{black}{\rm [Cl^-]}$ |
$\color{black}{\rm [Na^+]}$ |
$\color{black}{\rm [HO^-]}$ |
$\color{black}{\rm V_B < V_E}$ |
diminue |
constant |
augmente |
$\color{black}{\approx 0}$ |
$\color{black}{\rm V_B > V_E}$ |
$\color{black}{\approx 0}$ |
constant |
augmente |
augmente |
Données : Conductivités molaires ioniques
Conductivités molaires ioniques $\lambda$ de quelques ions à $\rm 25°C$
| Ion | $\lambda$ (en $mS.m^2.mol^{-1}$) |
| $\color{black}{\rm Na^+}$ | $\color{black}{5,0}$ |
| $\color{black}{\rm HO^-}$ | $\color{black}{19,9}$ |
| $\color{black}{\rm H_3O^+}$ | $\color{black}{35,0}$ |
| $\color{black}{\rm Cl^-}$ | $\color{black}{7,6}$ |
Interprétation de la courbe
Avant l'équivalence, la courbe est une droite de pente négative car $\rm \lambda H_3O^+ > \lambda Na^+$. De même, après l'équivalence, la courbe est une droite de pente positive car les $\rm Na^+$ et $\rm HO^-$ s'accumulent dans le bécher.