Les solides ioniques et moléculaires
Solides ioniques
Un solide ionique est constitué de cations et d'anions régulièrement disposés dans l'espace. Il est électriquement neutre. La cohésion d'un solide ionique est assurée par les interactions électrostatiques attractives entre les charges opposées, donc entre les cations (ions positifs) et les anions (ions négatifs).
Solides moléculaires
Un solide moléculaire est constitué d'un empilement régulier et ordonné de molécules dans l'espace. La cohésion d'un solide moléculaire est assurée par :
- Les interactions de Van der Waals toujours présentes : la cohésion d'un solide moléculaire constitué de molécules polaires est assurée par les interactions attractives existant entre les charges partielles de signes opposés et la cohésion d'un solide moléculaire constitué de molécules apolaires est assurée par les interactions attractives existant entre les charges partielles induites de signes opposés au sein des molécules (du fait du mouvement désordonné des électrons).
- La liaison hydrogène qui est une interaction attractive établie entre un atome d'hydrogène lié à un atome A très électronégatif et un atome B très électronégatif et porteur d'un doublet d'électrons non liant.

Solvants et solubilité
Types de solvants
Un solvant polaire, comme l'eau, est constitué de molécules polaires.
Un solvant apolaire, comme le cyclohexane, est constitué de molécules apolaires.
Règles de solubilité
Les solides ioniques sont solubles dans les solvants polaires, ils sont solubles dans l'eau par établissement d'interactions électrostatiques attractives entre les charges des ions du soluté et les charges partielles des molécules d'eau.
Les solutés moléculaires polaires sont solubles dans les solvants polaires.
Équation de dissolution
L'équation de dissolution d'un solide ionique $\mathrm{A}y\mathrm{B}x\mathrm {(s)}$ dans l'eau s'écrit :
$\rm A_{\mathcal y}B_{\mathcal x}(s) \rightarrow \mathcal y A^{\mathcal x+} (aq) + \mathcal x B^{\mathcal y-} (aq)$
La concentration en quantité de matière des ions $\mathrm A^{x+}$ et $\mathrm B^{y-}$ est :
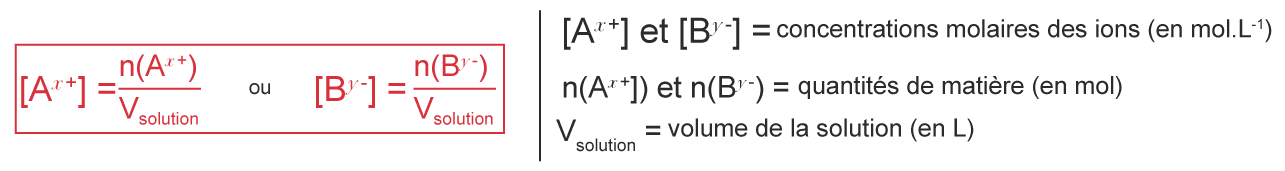
Extraction liquide-liquide
L'extraction liquide-liquide consiste à extraire une espèce présente dans un solvant S1 par un autre solvant $\rm S_2$. Ce solvant $\rm S_2$ est non miscible avec $\rm S_1$, l'espèce à extraire y est plus soluble que dans $\rm S_1$ et il respecte les règles de sécurité et d'environnement. Pour procéder à l'extraction, on utilise une ampoule à décanter.

Espèces amphiphiles et tensioactifs
Certaines espèces chimiques, amphiphiles, sont constituées de 2 parties :
- Une partie polaire et hydrophile (soluble dans l'eau),
- Une partie apolaire et lipophile (soluble dans les graisses).
Ces espèces amphiphiles sont des tensioactifs et expliquent les propriétés lavantes des savons.








