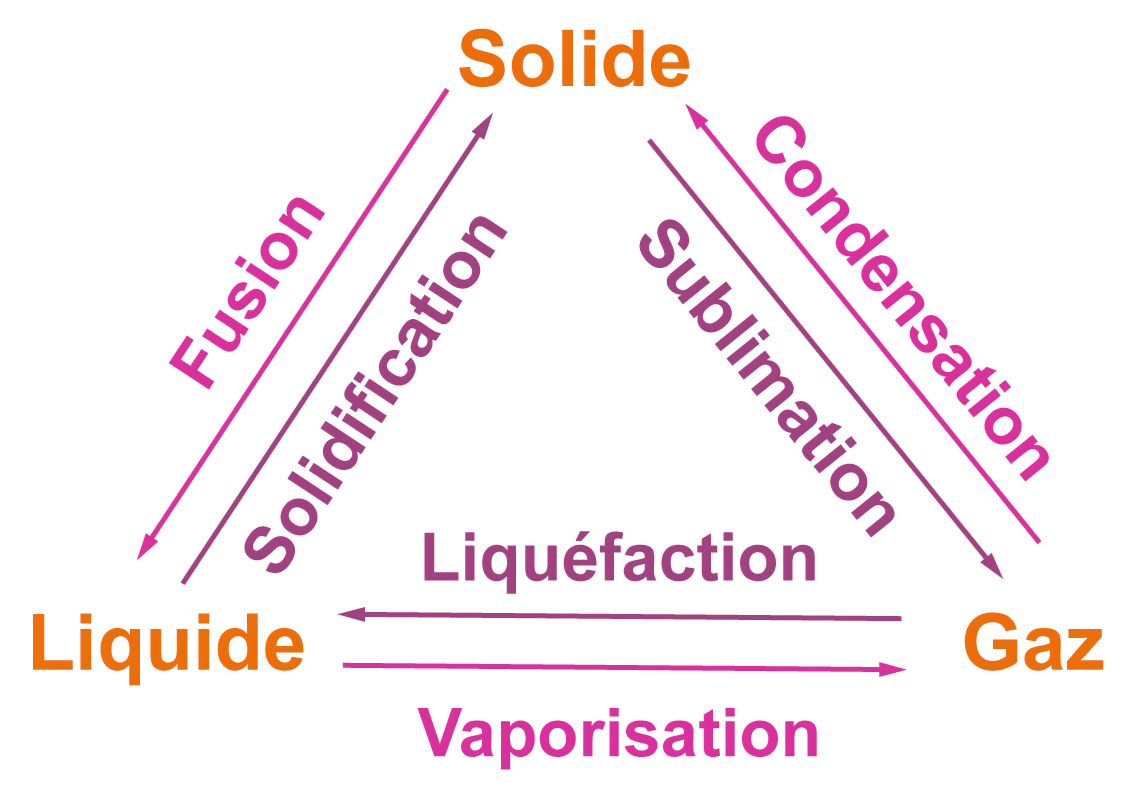
Les transformations physiques
Une transformation physique a lieu quand une espèce chimique passe d'un état physique (solide, liquide, gazeux) à un autre.
Distinction importante : fusion vs dissolution
Attention ne pas confondre fusion et dissolution : lors de la fusion, l'espèce chimique passe de l'état solide à l'état liquide alors que lors de la dissolution, le sucre par exemple ne « fond » pas, il se dissout dans l'eau.
Caractéristiques des changements d'état
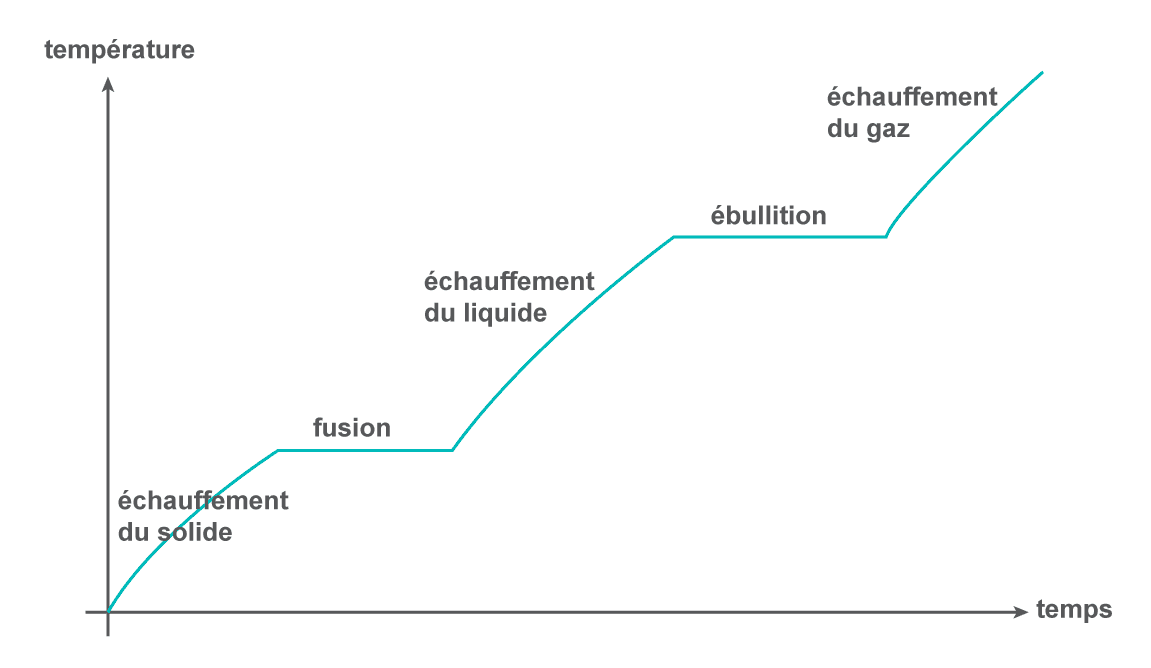
Les changements d'état d'un corps pur s'effectuent à une température constante sous une pression donnée.
Équation d'un changement de l'eau : la vaporisation
$\rm H_2O (l) \rightarrow H_2 O (g)$
Énergie massique de changement d'état
On définit l'énergie massique de changement d'état $\rm L$ ou énergie latente de changement d'état en $\rm J.kg^{-1}$. L'énergie $\rm Q$ transférée lors du changement d'état d'une masse d'une espèce est $\rm Q = m \times L$ avec $\rm Q$ en J et $\rm m$ en kg.
Si $\rm Q > 0$, alors transformation endothermique.
Mesure expérimentale
Pour déterminer l'énergie massique de changement d'état, on utilise un calorimètre.
Types de transformations énergétiques
Lors d'une fusion, d'une vaporisation ou d'une sublimation, l'énergie de l'espèce augmente et celle du milieu extérieur diminue (il se refroidit) : la transformation est endothermique.
Lors d'une solidification, d'une liquéfaction ou d'une condensation, l'énergie de l'espèce diminue et celle du milieu extérieur augmente (il se réchauffe) : la transformation est exothermique.


