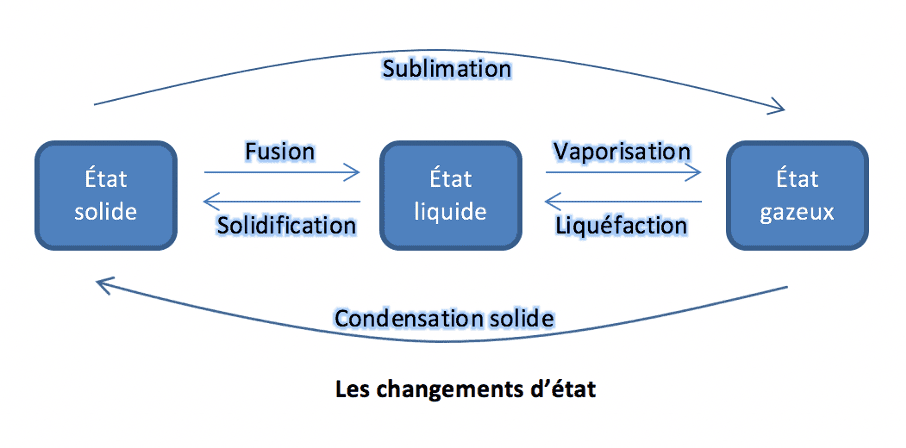
La température et les échelles de mesure
Définition de la température
La température est une grandeur physique qui caractérise l'agitation des particules qui composent la matière. Un thermomètre permet de mesurer cette grandeur.
L'échelle Celsius
En France, l'échelle de température adoptée est l'échelle Celsius $\rm (°C)$. Sur cette échelle, $\rm 0°C$ correspond à la température de solidification de l'eau et $\rm 100°C$ correspond à celle d'ébullition de l'eau (au niveau de la mer, sous la pression atmosphérique de $\rm 1~013~hPa$).
L'échelle Kelvin
Dans le système international, nous utilisons l'échelle Kelvin $\rm (K)$, qui ne comporte que des valeurs positives. Sur cette échelle :
- $\rm 0~ K$ correspond au zéro absolu, température où les particules sont totalement figées.
- $\rm 273,15~ K$ correspond à la température de solidification de l'eau
- $\rm 373,15~ K$ correspond à celle d'ébullition de l'eau.
Relation entre les échelles
Il existe une relation mathématique entre l'échelle Celsius et l'échelle Kelvin, où $\rm T~ (K)$ représente la température en Kelvin et $\rm T~ (°C)$ représente celle en degré Celsius :
$$\rm T~ (K) = T~ (°C)+273,15$$