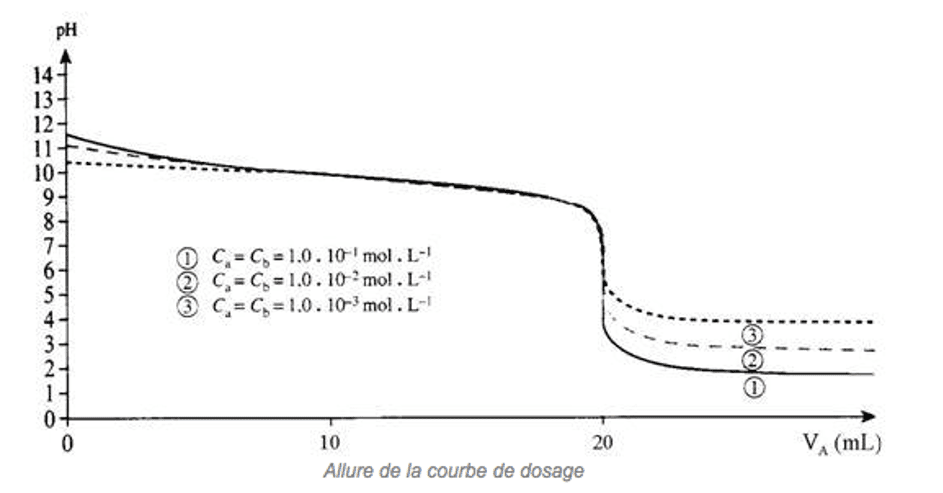
Dosage acide faible-base forte
Exemple : Dosage de l'acide éthanoïque de volume $\rm V_A$ et de concentration $\rm C_A$, par la solution d’hydroxyde de sodium de concentration $\rm C_B$.
Les espèces présentes dans le mélange sont l'acide éthanoïque, l'eau, les ions sodium $\rm Na^+$ spectateurs et les ions hydroxyde $\rm HO^-$ apportés par la solution d’hydroxyde de sodium.
La réaction de dosage est donc : $\rm CH_3COOH + HO^- \rightarrow CH_3COO^-+ H_2O$
Il y a équivalence lorsque les réactifs sont mélangés dans les proportions stoechiométriques de la réaction de dosage.
$\rm n(CH_3COOH)_{\text{introduit}} = n(HO)_{\text{introduit}}$
On note $\rm V_{BE}$, le volume de solution d’hydroxyde de sodium versée à l'équivalence.
La quantité d'ions $\rm HO^-$ introduite à l'équivalence est alors $\rm n(HO^-) = C_B \cdot V_{BE}$
A l'équivalence, on a donc la relation suivante : $\rm C_A \cdot V_A = C_B.V_{BE}$
A l'équivalence, dans le bécher, les espèces en présence sont l'eau, l'ion sodium, l'ion $\rm CH_3COO^-$ qui est une espèce basique. Par conséquent, le pH obtenu est basique $\rm (pHE > 7,0\: à\: 25°C)$.
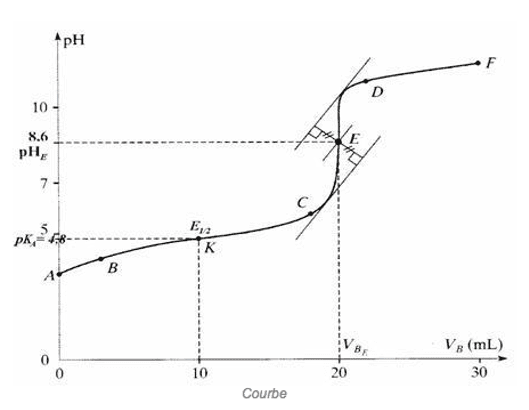
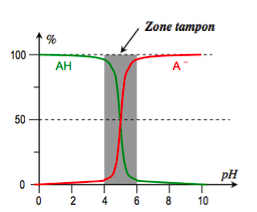
On appelle demi-équivalence l'état qui correspond à l'introduction d'une quantité de réactif titrant moitié de celle qui est nécessaire pour l'équivalence.
La demi-équivalence correspond donc à un volume

On voit ainsi que à la demi-équivalence l'acide $\rm CH_3COOH$ et sa base conjuguée $\rm CH_3COO^-$ sont présents en quantités égales dans le mélange.
A la demi-équivalence le pH est égal au pKA de l'acide.