Rappel
Le pH (potentiel Hydrogène) est la mesure de l’acidité d'une solution.
Il se mesure à l'aide d’un pH-mètre ou d'un papier indicateur de pH.
Il n'a pas d'unité.
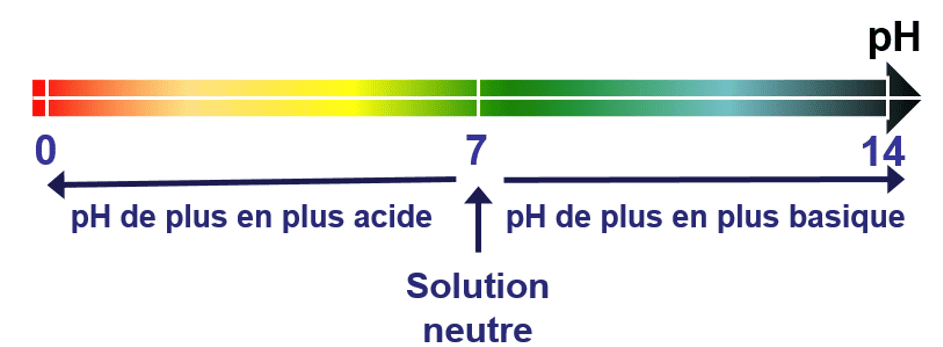
Si le pH est inférieur à 7, la solution est acide. Si le pH est voisin de 7, la solution est neutre. Si le pH est supérieur à 7, la solution est basique.
Toutes les solutions aqueuses contiennent des molécules d’eau, des ions hydrogène $\rm H^+$ et des ions hydroxyde $\rm OH^-$.
Une solution dont le pH est égal à 7 (neutre) contient autant d’ions $\rm H^+$ que d’ions $\rm OH^-$.
Une solution acide, comme l’acide chlorhydrique $\rm (H^+ + Cl^-)$, a un pH inférieur à 7 car elle contient davantage d’ions $\rm H^+$ que d’ions $\rm OH^-$. Ce sont les ions $\rm H^+$ qui sont responsables de l’acidité.
Une solution basique, comme la soude $\rm (Na^+ + OH^-)$, a un pH supérieur à 7 car elle contient davantage d’ions $\rm OH^-$ que d’ions $\rm H^+$. Ce sont les ions $\rm OH^-$ qui sont responsables de la basicité.
Si on mélange de la soude $\rm (Na^+ + OH^-)$ à de l’acide chlorhydrique $\rm (H^+ + Cl^-)$, on observe que la température du mélange augmente. La réaction chimique qui a lieu dégage de la chaleur. Les ions $\rm H^+$ réagissent avec les ions $\rm OH^-$ de la soude pour former des molécules d'eau.
Le bilan de la réaction chimique est alors :
acide chlorhydrique $+$ soude $\rightarrow$ eau
L’équation de la réaction est :
$\rm H^+ + OH^- \rightarrow H_2 O$
Les ions $\rm Na^+$ de la soude et $\rm Cl^-$ de l’acide chlorhydrique ne participent pas à la réaction, on dit que ce sont des ions spectateurs.
Cours
$\rm pH = -\log ([H_3O^+])$
$\rm [H_3O^+] = 10^{-pH}$
Quand le pH augmente la concentration en ion oxonium diminue et inversement.
La constante d’équilibre de la réaction d’autoprotolyse de l’eau (ci-dessous) est appelée produit ionique de l’eau et notée $\rm Ke$.
$\rm 2 H_2O \Leftrightarrow H_{3}O^+_{(aq)} + HO^-_{(aq)}$
A $\rm 25°C : Ke = [H_3O^+] \times [HO^-]$
On associe à cette constante la grandeur $\rm pKe = -\log (Ke) = 14 \:(à \:25°C)$.
Le produit ionique varie selon la température (à $\rm 15°C, \: Ke = 7,0\cdot 10^{-15}$ ; à $\rm 40°C, Ke = 3,0 \cdot 10^{-14}$).
On associe à cette constante la grandeur $\rm pKe = -\log (Ke) = 14 \:(à\:25°C)$.
Solutions acide, basique ou neutre
• Dans une solution neutre : $\rm [H_3O^+] = [HO^-]$
• Dans une solution acide : $\rm [H_3O^+] > [HO^-]$
• Dans une solution basique : $\rm [H_3O^+] < [HO^-]$


