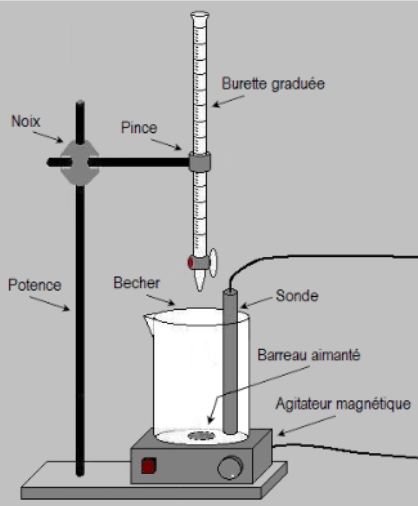
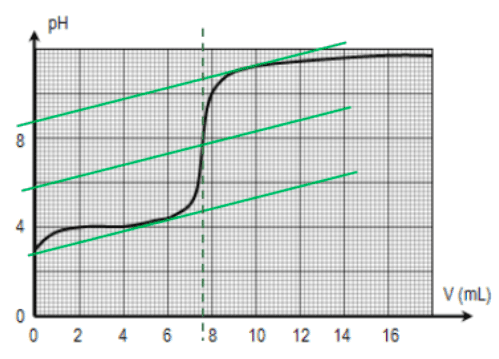
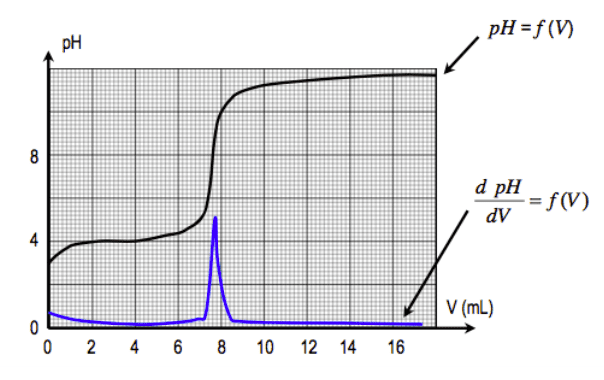
Un acide $\rm \bf AH$ est dit FORT s'il réagit totalement avec l'eau.
Une base $\rm \bf A^-$ est dite FORTE si elle réagit totalement avec l'eau.
Pour un acide fort
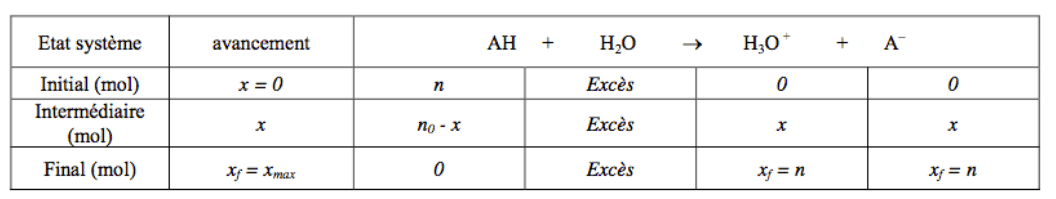
La concentration initiale en acide fort $\rm AH$ est $\displaystyle C = \frac{n}{V}$ ($V$ est le volume de solution). D'après le tableau d'avancement, on remarque que comme la réaction est totale, $\displaystyle [H_3O^+] = C = \frac{n}{V}$
Le pH d'une solution d'acide fort de concentration $C$ (en $\rm mol.L^{-1}$) est : $\rm \bf {pH = -\log (C)}$
Pour une base forte
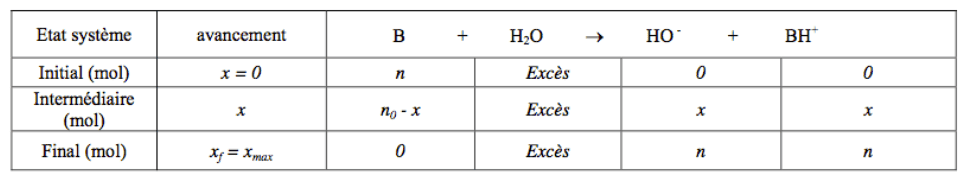
La concentration initiale en base forte $\rm B$ est $\displaystyle C = \frac{n}{V}$ ($V$ est le volume de solution). On a : $\displaystyle [HO^-] = C$.
$\displaystyle \Leftrightarrow \frac{Ke}{[H_3O+]} = C$ $\displaystyle \Leftrightarrow - \log\left(\frac{Ke}{[H_3O+]}\right) = -\log (C)$
$\displaystyle \Leftrightarrow -\log (Ke) + \log ([H_3O+]) = -\log (C)$
$\displaystyle \Leftrightarrow pKe - pH = -\log (C)$
$\displaystyle \Leftrightarrow pH = pKe + \log(C)$
Le pH d'une solution de base forte de concentration $C$ (en $\rm mol.L^{-1}$) est : $\bf \rm {pH = pKe + \log(C)}$