Les amines
$\rm R-NH_2$
$\text{Amine I (primaire)}$
$\rm R-NH-R'$
$\text{Amine II (secondaire)}$
$\begin{array}{ccc} & & \rm R' & & \\
& & | & & \\
\rm R & — & \rm N & — & \rm R'' \end{array}$
$\text{Amine III (tertiaire)}$
Amine primaire
On forme le nom à l'aide d'un préfixe qui est le nom de l'alcane (sans le "e" final) correspondant à la chaîne carbonée, suivi de l'indice de position du groupe amine sur cette chaîne et on termine par "amine".
$\begin{array}{ccc}\rm CH_3 & — & \rm CH & — & \rm CH_3 \\ & & | & & \\ & & \rm NH_2 & & \end{array}$
$\rm propan-2-amine$
$\begin{array}{ccc}\rm CH_3 & — & \rm CH_2& —& \rm CH_2NH_2\end{array}$
$\rm propan-1-amine$
Amine secondaire
On forme le nom à partir du nom de l'amine primaire correspondant au groupe carboné ayant le plus d'atomes de carbone que l'on fait précéder par la lettre "N" suivie d'un tiret et du nom de l'autre groupe carboné lié à l'atome d'azote.
$\begin{array}{ccc}\rm & & & & \rm H & &\\ & & \rm H_2 & & | & & \\ \rm H_3C & — & \rm C & — & \rm N & — & \rm CH_3\end{array}$
$\rm N-méthyléthanamine$
Amine tertiaire
On forme le nom à partir du nom de l'amine primaire correspondant au groupe carboné ayant le plus d'atomes de carbone que l'on fait précéder par la lettre $\rm "N"$ suivie d'un tiret et du nom d'un des deux autres groupes carbonés liés à l'atome d'azote, suivi d'une virgule et à nouveau de la lettre $\rm "N"$ suivie d'un tiret et du nom du deuxième groupe carboné lié à l'atome d'azote (dans le cas de groupes identiques on écrit deux lettres $\rm "N"$ séparées par une virgule puis un tiret et on utilise le préfixe $\rm "di"$ suivi du nom du groupe).
Réactivité des amines
La réactivité des amines est centrée essentiellement sur le doublet libre de l’azote.
Les amines sont toutes des bases plus fortes que l’ammoniac, car l’azote subit les effets donneurs des groupements alkyles qui lui sont substitués, ce qui renforce sa charge partielle négative et le rend plus nucléophile et plus basique.
La fixation d'un ion $\rm H^+$ sur le doublet non liant de l'azote se fait assez facilement ; ce sont des bases plus fortes que l'ammoniac, mais elles restent des bases faibles.
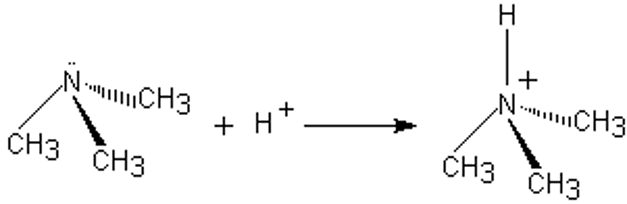
Amine |
(C2H5)2NH |
(CH3)2NH |
C2H5NH2 |
CH3NH2 |
pKa |
11,1 |
10,8 |
10,7 |
10,6 |
Amine |
(C2H5)3N |
(CH3)3N |
NH3 |
|
pKa |
10,6 |
9,8 |
9,2 |
|
---------> de plus en plus faibles --------->
Remarque : La basicité est croissante en passant de l'ammoniac aux amines primaires et secondaires. Les amines tertiaires ne sont pas les plus basiques : leur $\rm pK_a$ les place entre l'ammoniac et les amines primaires. Ce phénomène est dû à l'encombrement stérique des groupes $\rm R$ liés à l'azote ; ils empêchent les ions $\rm H^+$ d'approcher du doublet d'électrons libres de l'azote ce qui diminue la basicité de ces amines.


