Exemple d’oxydoréduction par voie sèche :
Le magnésium brûle dans le dioxygène de l'air en donnant des fumées blanches constituées de microcristaux d'oxyde de magnésium MgO (composé ionique) suivant la réaction :
$\rm 2Mg_{(s)} + O_{2(g)} \rightarrow 2MgO_{(s)}$
Il y a au cours de cette réaction, transfert d'électrons du magnésium (Mg) au dioxygène ($O_2$) et la réaction a lieu en absence d'eau, c'est dont une oxydoreduction par voie sèche.
Nombre d'oxydation :
C'est le nombre d'électrons perdu ou gagné par un atome ou, susceptible d'être gagné ou perdu suite à une rupture hétérolytique d'une liaison covalente.
La détermination du nombre d'oxydation obéit à certaines règles :
- À l'état atomique ou contenu dans une molécule de corps simple, tout atome a pour $n.o = 0$.
Exemple : $\rm n.o (C) = 0$ ; $\rm n.o (CI) = 0$ ; $\rm n.o (H)$ dans $\rm H_2 = 0$ ; $\rm n.o (0)$ dans $\rm O_2$. - Le nombre d'oxydation d'un élément dans un ion monoatomique est égal au nombre de charge de l'ion.
Exemple : dans $\rm Cu^{2+}$, $\rm n.o (Cu) = II$ ; dans $\rm O^{2-}$, $\rm n.o(O) = -II$, dans $\rm Fe^{2+}$, $\rm n.o(Fe) = III$ ; dans $\rm CI^-$, $\rm n.o (CI) = -1$
Identification d'une réaction d'oxydoréduction :
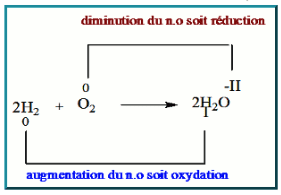
Lors de la synthèse de l'eau, le dilhydrogène est oxydé alors que le dioxygène est réduit, déterminons les $\rm n.o$ des différents éléments avant et après la réaction :
Lorsqu'un élément est oxydé, son $\rm n.o$ augmente.
Lorsqu'un élémen est réduit son $\rm n.o$ diminue.
L'espèce qui possède l'élément dont le $\rm n.O$ augmente est appelé réducteur, c'est le cas de $\rm H_2$.
L'espèce qui possède l'élément dont le $\rm n.o$ diminue est l'oxydant, c'est le cas de $\rm O_2$
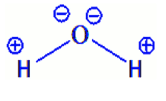
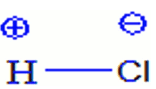
- Dans une molécule, le nombre d'oxydation d'un élément est égal à la charge fictive que porte l'atome de cet élément.
Dans $\rm n.o(O) = -II$, $\rm n.o(H) = I$
Dans $\rm n.o(CI) = -I$, $\rm n.o(H) = I$.
- Dans un ion polyatomiqe, la somme de n.o de tous les éléments est égale à la charge de l'ion.
Exemple : $\rm MnO^-_4$, $\rm n.o(Mn) + 4n.o(O) = -I$.
Exemple d’oxydoréduction par voie sèche :