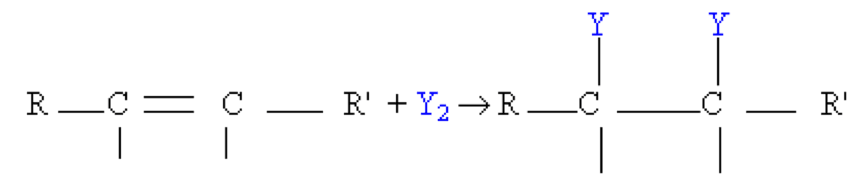II. Les alcènes
Les alcènes possèdent une double liaison C—C et leur formule est $\rm C_nH_{2n}$ s'il sont non cycliques.
Règles particulières :
- On remplace -ane par -ène précédé de la position $\rm C$ de la double liaison
- On ajoute $\rm Z$ ou $\rm E$ si diastéréoisomérie possible
Exemple :
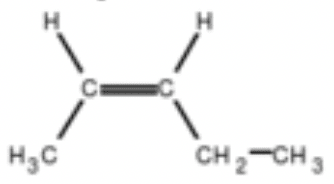
$\rm (Z)$ pen-2-ène
Les isoméries :
Exemple avec $\rm C_5H_{10}$ :
-
L'isomérie de chaîne :
Ils diffèrent par la structure de la chaîne des carbones :
$\begin{array}{ccc}
&& \rm H && \rm H_2 && \rm H_2\\
\rm H_2C & =& \rm C &-& \rm C &-& \rm C &- \rm CH_3\end{array}$
pent-1-ène
$\begin{array}{ccc}
& & \rm H && \rm H\\
\rm H_2C & = & \rm C & - & \rm C & - & \rm CH_3\\
& & & & | \\
& & & & \rm CH_3\end{array}$
3-méthyl-but-1-ène
-
L'isomérie de position de la double liaison :
Pour une chaîne donnée (par exemple celle du pent-1-ène) il peut y avoir plusieurs positions de la double liaison :
$\begin{array}{ccc}
&& \rm H && \rm H_2 && \rm H_2\\
\rm H_2C & =& \rm C &-& \rm C &-& \rm C &- \rm CH_3\end{array}$
pent-1-ène
$\begin{array}{ccc}
&& \rm H && \rm H_2 && \rm H_2\\
\rm H_3C & -& \rm C &=& \rm C &-& \rm C &- \rm CH_3\end{array}$
pent-2-ène
-
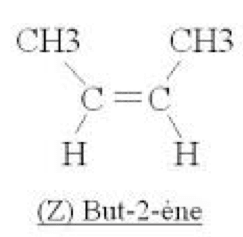
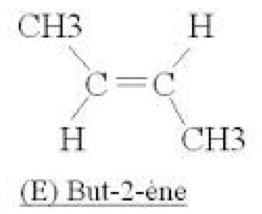
L'isomérie Z-E (ou cis-trans) :
Due à l'empêchement de la libre rotation autour des carbones de la double liaison.
1er cas : Il existe un hydrogène et un seul fixé sur chaque carbone de la double liaison, comme par exemple dans le but-2-ène :
On a l'isomère $\rm Z$ (ou cis) si les deux hydrogènes placés sur les carbones doublement liés sont du même côté de la double liaison :
On a l'isomère $\rm E$ (ou trans) si les deux hydrogènes placés sur les carbones doublement liés sont de part et d'autre de la double liaison :
Réaction d’addition : on casse la double liaison carbone pour y insérer de nouveaux constituants
-
L'hydrogénation :
Elle permet d'obtenir à partir d'un alcène un alcane
$\rm Alcène + Dihydrogène \rightarrow Alcane$
$\color{black}{\rm C_nH_{2N} + \color{blue}{H_2}}$ $\color{black}{\rightarrow}$ $\color{black}{\rm C_nH_{\color{blue}{2n+2}}}$
$\begin{array}{ccccc}
& & &\color{red}{\rm R} & \color{black}{-} & \color{red}{\rm C=C} & \color{black}{-} & \color{red}{\rm R'} \color{black}{+} \color{blue}{\rm H_2}\\
& & &&&| \qquad | \end{array}$ $\color{black}{\rightarrow}$ $\begin{array}
&& & \color{blue}{\rm H} && \color{blue}{\rm H}\\
& & | & & | \\
\color{black}{\rm R} & \color{black}{-} & \color{black}{\rm C} & \color{blue}{-} & \color{black}{\rm C} & \color{black}{-} & \color{black}{\rm R'}\\
& & | && | \end{array}$
-
L'halogénation :
Elle permet d'obtenir des dibromoalcanes ou des dichloroalcanes suivant que l'on a ajouté du dibrome $\rm (Br_2)$ ou du dichlore $\rm(Cl_2)$
$\rm Alcène + dibrome \rightarrow dibromoalcane$ ; $\rm C_nH_{2n}+ Br_2$ $\rightarrow$ $\rm C_n H_{2n} Br_2$
Avec $\rm Y=Br$ ou $\rm Cl$
Les polymères :
La polyaddition : Elle consiste en l'addition de molécules de grande taille identiques entre elles. Leur association forme une macromolécule qui est en fait la répétition d'un même motif un nombre fini de fois. Chaque fois que le motif est répété le degré de polymérisation du polymère augmente de 1. Le motif s'appelle le monomère.
L'assemblage de plusieurs motifs s'appelle un polymère.
Exemples de polymère : Le polyéthylène $\rm (P. E)$
- Le monomère est l'éthylène $\rm CH_2 = CH_2$
- L'équation bilan s'écrit $\rm n \times (CH_2 = CH_2) \rightarrow (— CH_2 — CH_2 —)n$
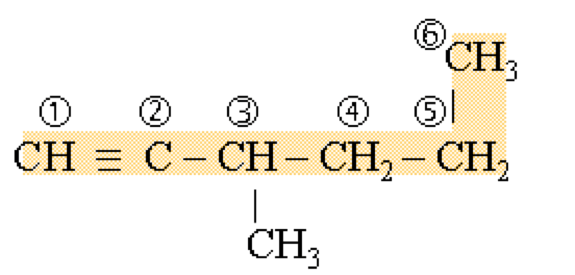
Les alcynes : $\rm C_n H_{2n-2}$, tel est la formule générale des alcynes, qui possèdent une triple liaison entre deux carbones.
- Repérer la chaîne carbonée principale. Celle-ci doit contenir le plus d'atomes de carbone et la triple liaison.
- Numéroter la chaîne principale de façon à ce que la triple liaison soit mise à la plus petite position possible. (ici : 1). Déterminer la longueur de la chaîne carbonée $\rm (6 = hex\textbf{yne})$.
La terminaison de la molécule sera : ...hex-1-yne - Déterminer la place de chaque ramification ainsi que son nom grâce aux terminaisons en "yl". Ajouter les ramifications avec en premier la place de la plus petite ramification, suivie des suivantes : 3-méthylhex-1-yne