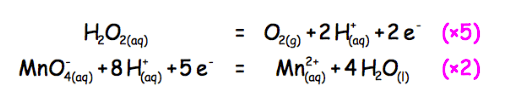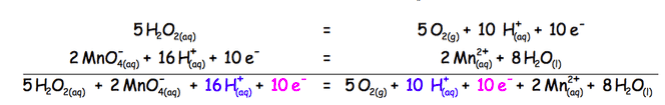Réaction entre le permanganate et l’eau oxygénée :
Couple $\rm MnO_{4^-} / Mn^{2+}$ :
$\rm MnO^-_{4(aq)} + 8H^+_{(aq)} + 5e^-$ = $\rm Mn^{2+}_{(aq)} + 4H_2O_{(l)}$
Couple $\rm O_2/H_2O_2$ :
$\rm H_2O_{2(aq)}$ = $\rm O_{2(g)} + 2H^+_{(aq)} + 2e^-$
On affecte à chaque demi-équation le coefficient multiplicateur adapté pour que le nombre d’électrons cédés soit égal au nombre d’électrons captés.
Puis on additionne membre à membre les deux demi-équations :
L’équation de la réaction est :
$\rm 5H_2O_{2(aq)} + 2MnO^-_{4(aq)} + 6H^+_{(aq)}$
=$\rm 5O_{2(g)} + 2 Mn ^{2+}_{(aq)} + 8H_2O_{(l)}$
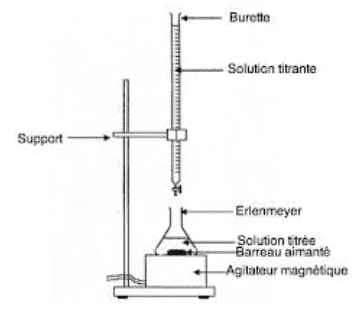
Dosage d’oxydoréduction :
Un dosage permet de déterminer la quantité de matière ou la concentration d’une espèce chimique dissoute dans une solution. Lors d’un dosage par titrage, la réaction chimique est totale et rapide.
Lors d’un titrage, un réactif titré A dont on cherche la concentration $\rm C_A$ réagit avec un réactif titrant B de concentration connue.
Au cours du titrage colorimétrique, on verse le réactif titrant jusqu’à ce que le réactif titré ait totalement réagi : on a alors atteint l’équivalence. Un changement de couleur du milieu réactionnel permet de repérer l’équivalence. À l’équivalence, les deux réactifs ont été totalement consommés : on a réalisé un mélange stoechiométrique.
À
Soit $\rm (C_A \times V_A )/ a$ = $\rm (C_B × V_B ) / b$
On peut ainsi déterminer la concentration du réactif titré $\rm C_A$.