Une réaction d’oxydo-réduction est une transformation chimique qui met en jeu des transferts d’électrons entre un oxydant et un réducteur. Un oxydant, noté $\mathrm Ox$, est une entité capable de capter un ou plusieurs électrons $\rm e^-$. Un réducteur, noté $\rm Red$, est une entité capable de céder un ou plusieurs électrons $\rm e^-$.
Un oxydant et un réducteur sont dits conjugués et forment un couple $\rm Oxydant/ Réducteur$ et sont reliés par une demi-équation électronique : $\mathrm Ox + \rm n e^- \Leftrightarrow Red$ avec $\rm n$ nombre d’électrons échangés.
Le passage de l’oxydant à son réducteur conjugué est une réduction : $\mathrm Ox + \rm n e^- \rightarrow Red$.
Le passage du réducteur à son oxydant conjugué est une oxydation : $\mathrm{Red} \rightarrow \mathrm Ox + \rm n e^-$.
Pour équilibrer une demi-équation électronique, il faut suivre plusieurs étapes :
- Ecrire les espèces conjuguées de part et d’autre de la double flèche et s’assurer de la conservation des éléments autres que $\rm H$ et $\rm O$.
- Assurer la conservation de l’élément $\rm O$ en ajoutant des molécules d’eau $\rm H_2O$.
- Assurer la conservation de l’élément $\rm H$ en ajoutant des ions hydrogène $\rm H^+$.
- Assurer la conservation de la charge électrique en ajoutant des électrons $\rm e^-$.
Une réaction d’oxydo-réduction est une réaction dont les réactifs sont un oxydant et un réducteur de deux couples $\rm oxydant/ réducteur$ différents.
Méthode pour écrire une équation d’oxydo-réduction :
- Déterminer les $2$ couples $\rm oxydant/ réducteur$ mis en jeu.
- Ecrire les demi-équations électroniques dans le sens de la réaction.
- Appliquer un coefficient multiplicateur pour obtenir le même nombre d’électrons dans les deux demi-équations électroniques.
- Additionner les deux demi-équations électroniques.
Piles :
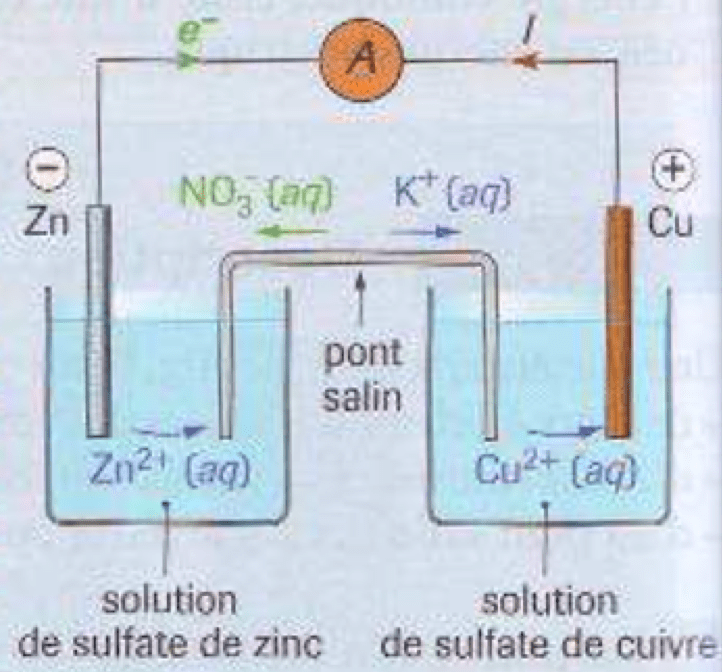
Une pile électrochimique est un générateur qui transforme de l'énergie chimique fournie par réaction d'oxydoréduction spontanée en énergie électrique.
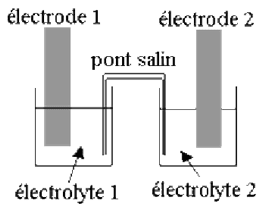
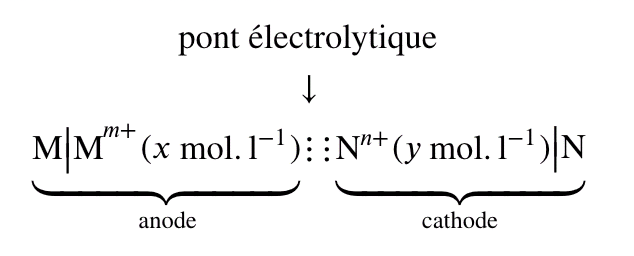
Chaque pile électrochimique est constituée de deux demi-piles. Chaque demi-pile est constrituée d'une électrode (en métal : $\rm M$) et d'un électrilyte (solution d'ions métallique $\rm M^{n+}_{(aq)}$).
Elles font donc référence chacune à un couple oxydo-réducteur $\bf M^{n+}_{(aq)}/M_{(s)}$.
Une jonction électrochimique est réalisée à l'aide d'un pont salin (solution ionique gélifiée) : il permet d'assurer la fermeture du circuit électrique et la neutralité de chaque électrolyte. Il n'intervient en rien dans l'équation de la réaction qui fournit l'énergie.