La matière est constituée d’un nombre trop grand d’entités (atomes, molécules, ions) pour que l’on puisse appliquer les lois physiques à l’échelle microscopique. On est donc obligé de décrire le comportement collectif d’un grand nombre d’espèces chimiques à l’aide de grandeurs physiques macroscopiques, mesurables à l’échelle humaine telles que la pression $\rm P$, le volume $\rm V$ ou la température $\rm T$.
La constante d’Avogadro, notée $\rm N_A$, permet de faire le lien entre le réel à l’échelle microscopique et le réel tel qu’on l’appréhende, à l’échelle macroscopique.
\[\color{pink}{\boxed{\color{black}{\rm N_A = 6,02 \times 10^{23}~mol^{-1}}}}\]
La température est une grandeur physique universelle. Cette mesure s’effectue avec un thermomètre gradué en degrés Celsius (noté $\rm °C$). Il existe d’autres unités de mesure : le degré Kelvin.
\[\color{green}{\boxed{\color{blue}{\rm °C = K - 273}}}$
La quantité d’énergie est mesurée en Joule, ou J (et donc 1 kiloJoule, noté kJ, vaut 1000 Joules).
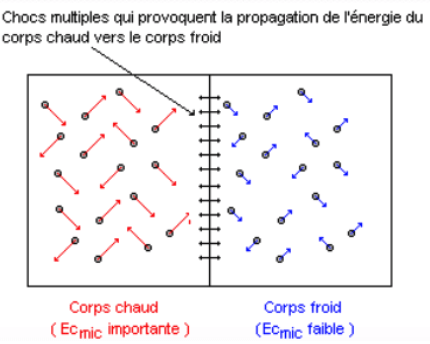
L'énergie interne U d'un système macroscopique est égale à la somme de :
- L'énergie cinétique microscopique de chaque particule du système. Elle est fonction de l'agitation thermique, donc de la température ;
- L'énergie potentielle d'interactions microscopiques entre les particules dues aux interactions gravitationnelle, électromagnétique, forte et faible entre les particules du système.
\[\rm U = E_c(micro) + E_p(micro)\]
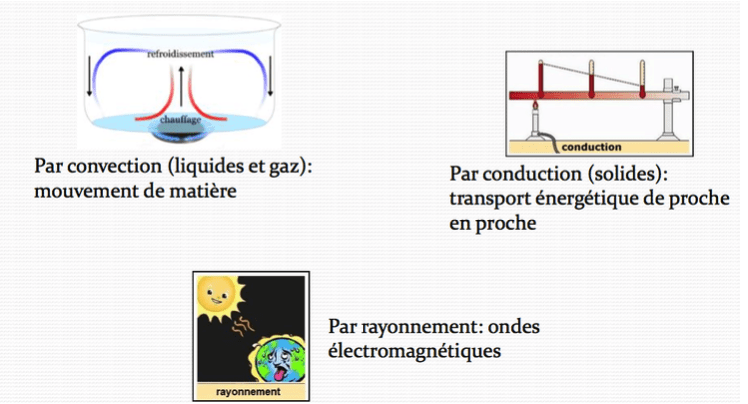
La capacité thermique $\rm C$ d’un corps condensé (solide ou liquide) correspond à l’énergie interne nécessaire pour augmenter sa température de $\rm 1°C$ sans le faire changer d’état physique.
On utilise couramment la capacité thermique massique $c$ (en $\rm J.kg^{-1}.°C^{-1}$) et dans ce cas, on obtient la relation :
\[\rm \Delta U ~= ~m \times \mathcal c \times \Delta T\]
Plus la capacité thermique massique d’un corps est grande, plus ce corps refroidit ou réchauffe difficilement.
Ex : $c_{\rm Aluminium} = \rm 897~J.K^{-1}.kg^{-1}$ et $c_{\rm eau} = \rm 4,18 \cdot 10^3~J.K^{-1}.kg^{-1}$
Il faut beaucoup plus apporter d’énergie à l’eau pour la réchauffer. Par contre, celle-ci est un meilleur isolant car elle refroidira plus difficilement