Conditions pour faire le dosage d'une espèce faible
- Réaction entre un acide faible et une base forte : un acide faible peut être dosé par une base forte à condition que le $\rm{pKa}$ associé au couple acide-base correspondant à cet acide faible soit inférieur à 11.
Exemple : l'acide acétique ($\rm{pKA}=4,8 <11$) réagit totalement avec une base forte telle que la soude. - Réaction entre une base faible et un acide fort : une base faible peut être dosée par un acide fort à condition que le $\rm{pKa}$ associé au couple acide-base correspondant à cette base faible soit supérieur à 3 (à 25°C).
Exemple : l'ammoniac ($\rm{pKa}$ ($\rm{NH}$+/$\rm{NH3})$$=9,2 > 3$) réagit totalement avec un acide fort tel que l'acide chlorhydrique.
Étude de la courbe $\rm{pH}$= $f$ ($\rm{VA}$ ou $\rm{VB}$)
Dosage d'un acide faible par une base forte
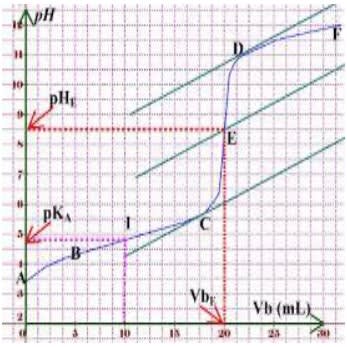
Dosoge d'une base faible par un acide fort
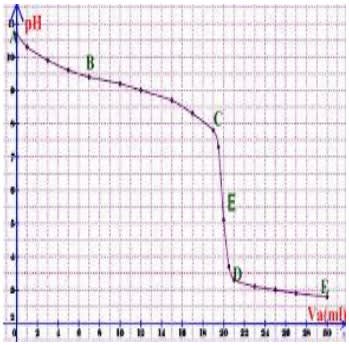
Quelle que soit la courbe ($\rm{pH}$=$f$($\rm{VA}$) ou $\rm{pH}$=$f$($\rm{VB}$)), on a quatre parties contrairement à la courbe du dosage entre un acide fort et une base forte qui présente trois parties :
- le décrochement initial caractéristique (partie $\rm{AB}$) ;
- un premier palier (partie $\rm{BC}$) comprenant un premier point $\rm{I}$ d'inflexion ($\rm{E}$2) ;
- une partie presque verticale (partie $\rm{CD}$), appelé le saut de $\rm{pH}$, contenant un deuxième point d'inflexion ($\rm{E}$) : c'est le point d'équivalence dont le $\rm{pH}$ correspondant est soit supérieur à ½$\rm{pKE}$ ($\rm{pHE} > 7$ à $\rm 25°C$) pour le dosage d'un acide faible par une base forte soit inférieur à ½$\rm{pKE}$ ($\rm{pHE} < 7$ à $\rm 25°C)$ pour le dosage d'une base faible par un acide fort ;
- un deuxième palier (partie $\rm{DF}$) ressemblant à la fin de la courbe entre un acide fort et une base forte.
Exploitation de la courbe
Soit le dosage d'un monoacide faible par une monobase forte :
$\rm{HA} + \rm{OH}^- \rightarrow \rm{A}^- + \rm{H_2O}$
$\rm{B} + \rm{H_3O}^+ \rightarrow \rm{BH}^+ + \rm{H_2O}$
À l'équivalence on a :
- 1er cas : $n\mathrm{(acide)}= n\mathrm{(OH^-})$.
Donc, $\rm{CaVa}$=$\rm{CbVE}$
$\rm{Ca}$ et $\rm{Va}$ sont respectivement la concentration et le volume de la solution acide, $\rm{Cb}$ et $\rm{VE}$ sont la concentration et le volume de base à l'équivalence.
Soit le dosage une monobase faible par d'un monoacide fort :
$\rm{B} + \rm{H_3O}^+ \rightarrow \rm{BH}^+ + \rm{H_2O}$
À l'équivalence, on a :
- 2e cas : $n(\mathrm{H_3O^+})=n\mathrm{(base)}$
ce qui donne
$\rm{CaVE}$=$\rm{CbVb}$
$\rm{Ca}$ et $\rm{Ve}$ sont la concentration et le volume à l'équivalence de l'acide fort, $\rm{Cb}$ et $\rm{Vb}$ sont la concentration et le volume de la solution de base faible.
- Conséquences :
Ainsi, à l'équivalence, le mélange contient l'espèce conjuguée ($\rm{A}$- ou $\rm{BH}$+) en plus de l'espèce conjuguée de l'espèce forte (qui est une espèce indifférente).
Donc le $\rm{pH}$ à l'équivalence est imposé par l'espèce conjuguée ($\rm{A}$- ou $\rm{BH}$+) de l'espèce faible. Ce qui donne :
-
- $\rm{pHE} > ½ \rm{pKE}$ ($\rm{pHE} > 7$ à $\rm25°C$) car présence de la base conjuguée $\rm{A}^-$ de l'acide faible $\rm{HA}$ (courbe 1).
- $\rm{pHE} < ½ \rm{pKE}$ ($\rm{pHE} < 7$ à $\rm25°C$) car présence de l'acide conjugué $\rm{BH}^+$ de la base faible $\rm{B}$ (courbe 2).
- Demi-équivalence
À la demi-équivalence :
$V_b = \dfrac{V_{bE}}{2} \Rightarrow V_{\rm{bE}} = 2V_{b}$ $\Rightarrow (1) : C_aV_a = 2C_bV_b$ $\Rightarrow$ $\dfrac{n_a}{2} = n_{bE'}$
Cela correspond à la neutralisation de la moitié de l'espèce faible par l'espèce forte : on parle de demi-équivalence. Ainsi le mélange contient en quantité égale une espèce acide ou base ($\rm{HA}$ ou $\rm{B}$) et son conjugué ($\rm{A}^-$ ou $\rm{BH}^+$) en plus de l'espèce indifférente conjuguée de l'espèce forte ($\rm{Na}^+$, $\rm{Cl}^-$, $\rm{NO3}^-$...) et des ions $\rm{H_3O}^+$ et $\rm{OH}^-$ provenant de la dissociation négligeable de l'eau (donc en quantité négligeable).
$\rm{pH}=\rm{pKa}$
Le $\rm{pH}$ à la demi-équivalence correspond au $\rm{pKa}$ du couple auquel est associé l'espèce faible $(\rm{pHE}½=\rm{PKa})$.
$E^{\prime}\left\{\begin{aligned} V_b & =\frac{V_{b E}}{2} \\ p H & =p K a\end{aligned}\right.$
Solution-tampon
Le premier palier montre que le $\rm{pH}$ ne varie presque pas lorsque l'on verse modérément l'espèce forte, c'est le cas aussi lorsque l'on dilue un peu le mélange : le mélange obtenu est une solution-tampon.
Définition
Une solution dont le $\rm{pH}$ varie très faiblement après ajout modéré d'acide ou de base ou après dilution modérée est appelée solution-tampon.
Exemple : une solution contenant un mélange équimolaire d'une espèce acide ou base et son conjugué est une solution-tampon.
Obtention d'une solution tampon
Pour obtenir une solution-tampon, on peut :
- soit mélanger en quantités égales un acide faible et sa base conjuguée ;
- soit mélanger un acide faible et une base forte tel que le volume de la base forte soit égal à la moitié du volume de base pour atteindre l'équivalence $(\rm V_b=½V_E)$ ; c'est la demi-équivalence.
- soit mélanger une base faible et un acide fort tel que le volume de l'acide fort soit égal à la moitié du volume d'acide à l'équivalence $(\rm{V_a}=½\rm{V_E})$ ; c'est la demi-équivalence.


