I. Autoprotolyse de l'eau
L'eau pure conduit très faiblement le courant électrique. Cela grâce à la présence des ions hydronium H3O+ et hydroxyde OH- qui se sont formés lors de la réaction entre deux molécules d'eau : c'est l'autoprotolyse de l'eau. La molécule d'eau étant polaire, elle ionise toute les molécules polaires, cause pour laquelle on dit que l'eau est un solvant ionisant.
$\rm 2H_2O \rightleftharpoons H_3O^+ + OH^-$
2. Produit ionique de l'eau
- Soit l'équilibre chimique suivant :
$\alpha \rm{A} + \beta \rm{B} \rightleftharpoons \gamma \rm{C} + \delta \rm{D}$
on a
$\rm{K_c}$= $\dfrac{[\rm{A}]^\alpha \cdot [\rm{B}]^\beta}{[\rm{C}]^\gamma \cdot [\rm{D}]^\delta}$
Mais si un des corps est le solvant eau, il n'est pas tenu en compte dans l'expression de $\rm K^c$.
Exemple de l'autoprotolyse de l'eau :
$\rm 2H_2O \rightleftharpoons H_3O^+ + OH^-$
$\rm K_c = H_3O^+ \times OH^- = K_e$ ;
Ici $\rm{K_c}$ est appelée particulièrement produit ionique de l'eau et notée : $\rm{K_e}$.
$\rm{K_e}=[\rm{H_3O^+}]\cdot[\rm{OH^-}]$
À $\boxed{\rm{25°C},~ \rm{K_e}=\rm{10^{-14}}}$
On définit aussi la constante $\rm{pK_e}$ telle que $\rm{pK_e}=-\log \rm{K_e}$ et $\rm{k_e}=\rm{10^{-pK_e}}$, à $\rm{25°C},~ \rm{pK_e}= -\log \rm{K_e} =14$.
3. Les lois de conservation
- De la charge électrique : c'est l'électroneutralité ; il y a en solution autant de charges positives (apportées par les cations) que de charges négatives (apportées par les anions).
Ainsi pour une solution ne contenant que les ions $\rm{A^{p+}}$, $\rm{B^{r+}}$, $\rm{C^{q-}}$ et $\rm{D^{s-}}$, l'électroneutralité se traduit par :
$p[\rm{A^{p+}}] + r[\rm{B^{r+}}]= q[\rm{C^{q-}}] + s[\rm{D^{s-}}]$.
- De la matière : cela concerne les équilibres chimiques.
$\rm{AH} + \rm{H_2O} \rightleftharpoons \rm{A^-} + \rm{H_3O^+}$
$\boxed{[\rm{AH}]_0=[\rm{AH}]+[\rm{A^-}]}$
On n'a pas raisonné sur les ions $\rm{H_3O^+} $ car une partie de ces ions hydronium provient de l'autoprotolyse de l'eau alors que $\rm{A^-}$ provient intégralement de la dissociation de $\rm{AH}$.
La conservation de la matière, pour un corps donné, se traduit par :
Concentration initiale = concentration finale + concentration du produit donné
Remarque : Corps majoritaire, corps minoritaire.
Un corps $\rm{A}$ est minoritaire devant un corps $\rm{B}$ (on dit aussi que le corps $\rm{B}$ est majoritaire devant $\rm{A}$) si $100.[\rm{A}] < [\rm{B}]$.
$\rm{A}$ est ultraminoritaire $(\rm{B}$ est ultramajoritaire) si $\rm{10^4}.[\rm{A}]< [\rm{B}]$.
4. pH d'une solution diluée
$\rm{pH}=- \log [\rm{H_3O^+}]$ et $[\rm{H_3O^+}]=\rm{10^{-pH}} ~\rm{mol.L^{-1}}$.
On considère comme solutions diluées, celles dont les concentrations molaires sont inférieures à $\rm{10^{-1}~mol.L^{-1}}$.
$\rm{pH}=- \log [\rm{H_3O^+}]$ est valable pour $[\rm{H_3O^+}] < \rm{10^{-1} ~mol.L^{-1}}$ et $[\rm{OH^-}] <\rm{10^{-1}~mol.L^{-1}}$.
Le $\rm{pH}$ est une fonction décroissante de la concentration en ions hydronium. Nous nous limiterons aux solutions dont le $\rm{pH}$ est compris entre 0 et 14. Mais des solutions de $\rm{pH}$ négatif ou supérieur à 14 existent.
4. Nature d'une solution
- Solutions acides : pour toute solution acide $\rm{pH} < (½) \rm{pK_e}$, ainsi à $\rm{25°C}$, $\rm{pH} < 7$ pour les solutions acides.
- Solutions basiques : pour toute solution basique $\rm{pH}>½\rm{pK_e}$, donc à $\rm{25°C}$, $\rm{pH} > 7$.
- Solutions neutres : une solution est neutre si $[\rm{H_3O^+}]=[\rm{OH^-}] \rightarrow$ pour toute solution neutre $\rm{pH}=½\rm{pK_e}$ ; ainsi à $\rm{25°C}$, $\rm{pH}=7$.
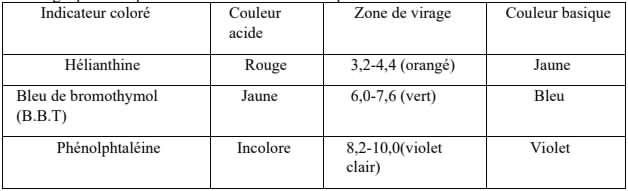
- Indicateurs colorés : un indicateur coloré est une substance qui change de couleur selon le $\rm{pH}$. Ses couleurs en milieux acide et basique sont appelées respectivement teintes acide et basique. Il existe un intervalle de $\rm{pH}$ où les deux couleurs se superposent : c'est la zone de virage qui correspond à la teinte sensible.
Exemples d'indicateurs colorés :