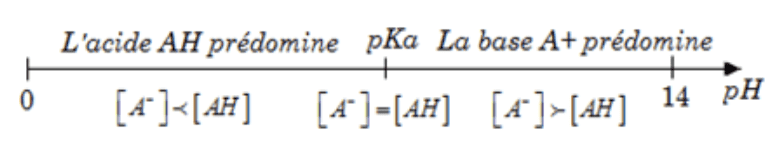Définitions de Brönsted
- Un acide est toute espèce chimique capable de céder un ou plusieurs protons $\rm{H}^{+}$.
- Un acide est faible s'il donne un ou plusieurs protons $\rm{H}^{+}$ par une réaction partielle.
- Une base est toute espèce capable de capter un ou plusieurs protons $\rm{H}^{+}$. $\rm{RCO}O^{-}$.
- Une base est faible s'il capte un ou des protons par une réaction partielle.
- Une réaction acide-base est un transfert de proton(s) entre l'espèce acide et l'espèce base.
Couples acide-base
L'acide $\rm{HA}$ libère un proton et se transforme en $\rm{A}^{-}$ et la base $\rm{A}$ capte un proton pour donner $\rm{HA}$. On dit que $\rm{HA}$ et $\rm{A}$ constituent un couple acide-base noté $\rm{HA/A^{-}}$. On passe d'une espèce à une autre par transfert d'un proton selon l'un des schémas réactionnels suivants :
$\rm{HA} \rightleftharpoons \rm{A}^{-} + \rm{H}^{+}$ pour le couple $\rm{HA/A^{-}}$ et $\rm{B} + \rm{H}^{+} \rightleftharpoons \rm{BH}^{+}$ pour le couple $\rm{BH^{+}/B}$.
Remarque : L'eau peut se comporter soit comme un acide soit comme une base, on dit que c'est une espèce amphotère ou un ampholyte. C'est une espèce acido-basique faible.
$\rm{H_2O} \rightleftharpoons \rm{OH}^{-} + \rm{H}^{+}$ pour le couple $\rm{H_2O/OH^{-}}$ et $\rm{H_2O} + \rm{H}^{+} \rightleftharpoons \rm{H_3O^{+}}$ pour le couple $\rm{H_3O^{+}/H_2O}$.
Constante d'acidité
En tenant compte des définitions de Brönsted et sachant que dans les solutions acides et basiques il y a respectivement des ions hydronium $\rm{H_3O^{+}}$ et hydroxyde $\rm{OH^{-}}$, on peut dire que :
- un acide faible est toute espèce chimique qui, en solution aqueuse, donne un ou plusieurs protons au solvant eau par une réaction partielle : $\rm{HA} + \rm{H_2O} \rightleftharpoons \rm{A}^{-} + \rm{H_3O^{+}}$ ou $\rm{BH^{+}} + \rm{H_2O} \rightleftharpoons \rm{B} + \rm{H_3O^{+}}$ ;
- une base faible est toute espèce chimique qui, en solution aqueuse, prend un ou plusieurs protons au solvant eau par une réaction partielle : $\rm{A}^{-} + \rm{H_2O} \rightleftharpoons \rm{AH} + \rm{OH}^{-}$ ou $\rm{B} + \rm{H_2O} \rightleftharpoons \rm{BH^{+}} + \rm{OH}^{-}$.
On appelle constante d'acidité d'un couple acide-base, noté $\rm{K_A}$ ou $\rm{K_a}$, la constante d'équilibre correspondant à la réaction entre la forme acide ($\rm{HA}$ ou $\rm{BH^{+}}$) et l'eau.
$\displaystyle K_a = \frac{[\rm{A}^{-}][\rm{H_3O^{+}}]}{[\rm{AH}]} = \frac{[\rm{base}][\rm{H_3O^{+}}]}{[\rm{acide}]} = \rm{cste}$
On définit aussi la constante $\rm{pK_a}$ telle que $\displaystyle \rm{pK_a} = -\log \rm{K_a} \rightleftharpoons \rm{K_a} = 10^{-\rm{pK_a}}$
Force d'un acide
Avec le $\rm{K_a}$ ou $\rm{pK_a}$
Un acide est d'autant plus fort si le $\rm{K_a}$ de son couple acide/base est élevé donc le $\rm{pK_a}$ est faible.
Avec le pH
Entre deux acides de même concentration, le plus fort est celui qui a le pH le plus petit.
Avec le coefficient de d'ionisation $\alpha$
Un acide est d'autant plus fort si son coefficient de d'ionisation $\alpha$ est élevé.
Prévision de la réaction acido-basique
Une réaction acide-base met en jeu deux couples acide-base. Spontanément, elle a lieu entre l'acide le plus fort et la base la plus forte pour donner l'acide le plus faible et la base la plus faible.
Considérons la réaction entre un acide $\rm{A_1}$ du couple $\rm{A_1/B_1}$ et une base $\rm{B_2}$ du couple $\rm{A_2/B_2}$ de constante d'acidité respective $\rm{K_{a_1}}$ et $\rm{K_{a_2}}$: $\rm{A_1} + \rm{B_2} \rightleftharpoons \rm{B_1} + \rm{A_2}$.
La constante de réaction est :
$\displaystyle K_r = \frac{[\rm{A_2}] [\rm{B_1}]}{[\rm{A_1}] [\rm{B_2}]} = \frac{[\rm{A_2}] [\rm{B_1}]}{[\rm{A_1}] [\rm{B_2}]} \cdot \frac{[\rm{H_3O^{+}}]}{[\rm{H_3O^{+}}]} = \frac{\rm{K_{a_1}}}{\rm{K_{a_2}}}$
$\displaystyle \Rightarrow K_r = \frac{\rm{K_{a_1}}}{\rm{K_{a_2}}} = \frac{10^{-\rm{pK_{a_1}}}}{10^{-\rm{pK_{a_2}}}} = 10^{\rm{pK_{a_2}} - \rm{pK_{a_1}}}$
- La transformation est favorisée dans le sens 1 (de la gauche vers la droite) si $\rm{K_r} > 1$ ; elle est favorisée dans le sens inverse (de la droite vers la gauche) si $\rm{K_r} < 1$.
- Si $\rm{K_r} > 10^3 \rightleftharpoons \Delta \rm{pK_a} > 3$, la réaction est totale : on dit qu'elle est quantitative.
pH de la solution aqueuse d'une espèce faible
$\displaystyle K_a = \frac{[\rm{A^{-}}] [\rm{H_3O^{+}}]}{[\rm{AH}]}$
On a : $\displaystyle -\log K_a = -\log \frac{[\rm{A^{-}}] [\rm{H_3O^{+}}]}{[\rm{AH}]} = -\log [\rm{H_3O^{+}}] - \log \frac{[\rm{A^{-}}]}{[\rm{AH}]}$
Or $\displaystyle -\log [\rm{H_3O^{+}}] = \rm{pH} \Rightarrow \rm{pK_a} = \rm{pH} - \log \frac{[\rm{A^{-}}]}{[\rm{AH}]}$
D'où $\displaystyle \rm{pH} = \rm{pK_a} + \log \frac{[\rm{A^{-}}]}{[\rm{AH}]} = \rm{pK_a} + \log \frac{[\rm{base}]}{[\rm{acide}]}$
Domaine de prédominance
$\displaystyle \rm{pH} = \rm{pK_a} + \log \frac{[\rm{A^{-}}]}{[\rm{AH}]} \Rightarrow \log \frac{[\rm{A^{-}}]}{[\rm{AH}]} = \rm{pH} - \rm{pK_a}$
On a :
- Si $\displaystyle \rm{pH} = \rm{pK_a} \Rightarrow \log \frac{[\rm{A^{-}}]}{[\rm{AH}]} = 0 \Rightarrow \frac{[\rm{A^{-}}]}{[\rm{AH}]} = 1 \Rightarrow [\rm{A^{-}}] = [\rm{AH}]$ : la solution considérée est dite solution tampon efficace.
- Si $\displaystyle \rm{pH} > \rm{pK_a} \Rightarrow \frac{[\rm{A^{-}}]}{[\rm{AH}]} > 1 \Rightarrow [\rm{A^{-}}] > [\rm{AH}]$ : la forme basique $\rm{A^{-}}$ prédomine.
- Si $\displaystyle \rm{pH} < \rm{pK_a} \Rightarrow \frac{[\rm{A^{-}}]}{[\rm{AH}]} < 1 \Rightarrow [\rm{A^{-}}] < [\rm{AH}]$ : la forme acide $\rm{AH}$ prédomine.