Définition et structure d'un acide carboxylique
Un acide carboxylique comporte dans sa molécule un groupe carboxylique $–\rm{CO-OH}$ ou $–\rm{COOH}$ (l'atome de carbone du groupe carboxyle est le carbone fonctionnel). Sa formule générale est $\rm{R-CO-OH}$ ou $\rm{R-COOH}$ ou $\rm{RCOOH}$. Sa formule générale est $\rm{C}_n\rm{H}_{2n}\rm{O}_2$.
Nomenclature des acides carboxyliques
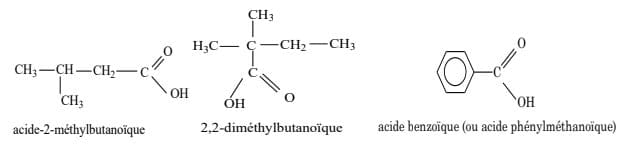
Le nom d'un acide carboxylique, toujours précédé du mot acide, s'obtient en remplaçant le « -e » final du nom de l'hydrocarbure de même chaîne carbonée par la terminaison « -oïque » ; le carbone fonctionnel porte toujours l'indice de position 1 (à ne pas spécifier).
Exemple : $\rm{HCOOH}$ acide méthanoïque ; $\rm{CH}_3 – \rm{COOH}$ acide éthanoïque
Propriétés chimiques des acides carboxyliques
-
Ionisation dans l'eau : réagissant partiellement avec l'eau, les acides carboxyliques sont des acides faibles selon l'équation-bilan$\rm{R-COOH} + \rm{H}_2\rm{O} \rightleftharpoons \rm{R-COO}^- + \rm{H}_3\rm{O}^+$.
-
La décarboxylation (perte de $\rm{CO}_2$) intramoléculaire fournit un hydrocarbure alors que celle entre deux molécules d'acide (décarboxylation intermoléculaire) conduit à une cétone.
$\rm{R-COOH} \rightarrow \rm{RH} + \rm{CO}_2$
$2 \rm{R-COOH} \leftrightharpoons \rm{R-CO-R} + \rm{CO}_2 +\rm{H}_2\rm{O}$
Les dérivés d'acide carboxylique
On appelle dérivé d'acide un composé organique dont la molécule est de la forme $\rm{R-CO-Y}$ où le groupe $-\rm{Y}$, remplaçant le groupe hydroxyle –\rm{OH}, peut être :
- $\rm{Cl}$ (chlorure d'acyle),
- $\rm{O-R'}$ (ester),
- $\rm{O-CO-R'}$ (anhydride d'acide),
- $\rm{NH}_2$(amide non substituée),
- $\rm{NH-R'}$ (amide monosubstituée),
- $\rm{N(R')-R''}$ (amide disubstituée), etc.
Chlorure d'acyle
Il est obtenu par action d'un agent chlorurant ($\rm{PC1}_3$, $\rm{PC1}_5$ ou $\rm{SOCl}_2$ chlorure de thionyle) sur un acide carboxylique.
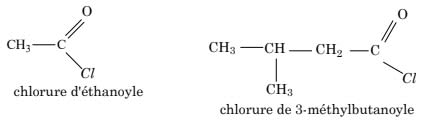
Pour nommer un chlorure d'acyle, on remplace le mot acide par « chlorure de » et la terminaison « -ïque » ou « -ique » par « -yle ».
Exemple :
Anhydride d'acide
Il résulte de :
- l'élimination d'une molécule d'eau entre deux molécules d'acide en présence du déshydratant puissant le décaoxyde de tétraphosphore $\rm{P}_4\rm{O}_{10}$
$\rm{R-CO-OH+HO-OC-} \rightarrow \rm{R-CO-O-OC-R} + \rm{H}_2\rm{O}$
- l'action d'un chlorure d'acyle sur un carboxylate de sodium :
$\rm{R-CO-C1+R'-CO-ONa} \rightarrow \rm{R-CO-O-CO-R' +\rm{Na}^+ + \rm{Cl}^-}$
Si les radicaux $\rm{R}$ et $\rm{R'}$ sont identiques, on a un anhydride symétrique, sinon il s'agit d'un anhydride dissymétrique.
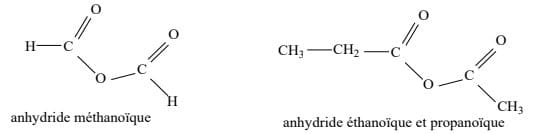
Pour nommer un anhydride symétrique, on remplace le mot acide par anhydride. Dans le cas d'un anhydride dissymétrique, le nom dérive de ceux des deux acides (nommés par ordre alphabétique) dont il comporte les deux chaînes carbonées, séparées par « et » ; ces noms sont précédés du mot « anhydride » qui remplace « acide ».
Exemples :
Esters
Ils peuvent être obtenus de deux façons :
- par estérification directe : action d'un acide carboxylique sur un alcool donne un ester :
$\rm{R-CO-OH + R'-OH} \leftrightharpoons \rm{R-CO-O-R'} + \rm{H}_2\rm{O}$. Cette réaction est lente, limitée reversible et athermique.
- par estérification indirecte : action d'un chlorure d'acyle ou d'un anhydride d'acide sur un alcool. La réaction est rapide, totale et exothermique avec le chlorure d'acyle et elle est moins vive avec l'anhydride d'acide.
Le nom d'un ester comporte deux parties :
- la première partie désigne la chaîne carbonée contenant l'atome de carbone fonctionnel ; son nom dérive de celui de l'acide carboxylique correspondant en remplaçant la terminaison « -ique » par « -ate » ;
- la seconde partie de la chaîne carbonée correspondant au radical de l'alcool ; elle est nommée en tant que radical alkyle (le « e » final est conservé).
Les deux noms sont séparés par « de » et l'atome de carbone fonctionnel et l'atome de carbone du radical directement lié à l'atome d'oxygène portent les indices de position 1.
Exemples : \rm{H – COO – CH}$_3$ : méthanoate de méthyle ;
\rm{CH}$_3$ – \rm{CH} – \rm{CH}$_2$ – \rm{C} – \rm{COO} – \rm{CH} – \rm{CH}$_3$ : 2 – éthyl – 2,4 – diméthylhexanoate d'isopropyle
- la saponification est l'action d'une base forte (ce sont les ions \rm{OH} qui réagissent) sur un ester:
![]()
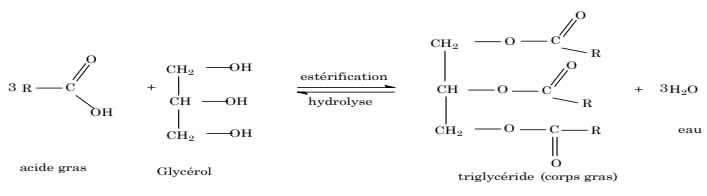
La réaction est lente et totale. Elle est utilisée pour la fabrication de savons à partir de corps gras (esters naturels constitués à 95 % de triesters du propan-1, 2, 3-triol ou glycérol et d'acides gras (sont des acides carboxyliques avec des chaînes carbonées non ramifiées possédant de 4 à 22 atomes de carbone et éventuellement une ou plusieurs doubles liaisons \rm{C=C}).
Amides
Elles sont obtenues de trois façons :
- par déshydratation d'un carboxylate d'ammonium (obtenu par action d'un acide carboxylique sur l'ammoniac)
\rm{R-COOH + NH}$_3$ $\rightarrow$ (\rm{R-COO}$^-$ + \rm{NH}$_4$ ^+) carboxylate d'ammonium ;
- par chauffage assez poussé (\rm{RCOO}$^-$\rm{+ NH}$_4$$^+$) $\rightarrow$\rm{R-CO-O-NH}$_2$ + \rm{H}$_2$\rm{O} ;
- à partir d'un chlorure d'acyle sur l'ammoniac, une amine primaire ou une amine secondaire (ces réactions sont rapides et totales). Pas de réaction avec une amine tertiaire.
\rm{R-CO-Cl + 2 NH}$_3$ $\rightarrow$ \rm{R-CO-NH}$_2$ 4+
\rm{NH}$^+$ + \rm{Cl}^-$
\rm{R-CO-Cl + R'-NH}$_2$ $\rightarrow$ \rm{R-CO-ΝΗ-}
\rm{R'+HC1}
\rm{R-CO-Cl + R'-NH-R''} $\rightarrow$ \rm{R-CO-N(R')R''} + \rm{HCl}
- à partir d'un anhydride d'acide sur l'ammoniac ou une amine primaire ou secondaire (réaction totale et moins rapide qu'avec le chlorure d'acyle)
\rm{R-CO-O-CO-R + R'-NH}$_2$ $\rightarrow$ 2 \rm{R-CO-NH-R'} (l'acide formé réagit avec l'amine en excès) ;
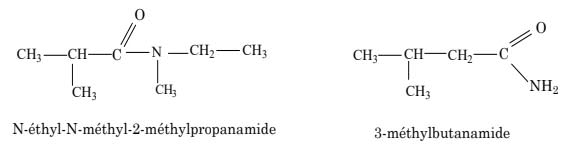
- pour nommer une amide non substituée (\rm{R-CO-NH}$_2$), on utilise le nom de l'acide carboxylique correspondant en enlevant le mot acide et en remplaçant la terminaison « -oïque » par « -amide » ;
- pour les amides monosubstituées (\rm{R-CO-NH-R'}) et disubstituées (\rm{R-CO-N(R')-R'}), le nom des groupes alkyle (ou aryle) liés à l'atome d'azote sont précédés de la lettre \rm{N} suivi d'un tiret et cités, par ordre alphabétique, avant le nom de l'amide non substituée correspondante :