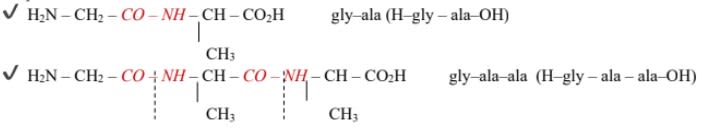Définitions et nomenclature
Définition
Un acide $\alpha$-aminé est un composé organique qui possède dans sa molécule un groupe amino ($\rm{-NH_2}$) ou une fonction amine et un groupe carboxyle ($\rm{-COOH}$). Sa formule générale est :
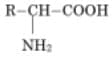
L'atome de carbone fonctionnel est en « position $\alpha$ » par rapport à l'atome de carbone du groupe carboxyle d'où le mot alpha ($\alpha$).
Le groupe R- est appelé le résidu. S'il n'est pas un atome d'hydrogène alors le carbone fonctionnel est asymétrique ; cela veut dire que presque tous les acides $\alpha$–aminés sont chiraux, donc présentent deux énantiomères.
Nomenclature
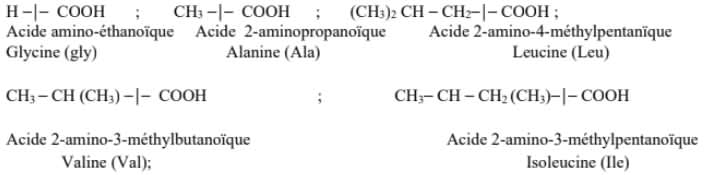
Les acides $\alpha$-aminés sont souvent désignés par des noms employés en biochimie. Dans la nomenclature officielle, les acides $\alpha$-aminés sont nommés comme les acides carboxyliques. Le groupe $\rm{NH_2}$ porte le nom « amino » précédé de son indice de position.
Stéréoisoméries
Des corps de même formule brute mais ayant des propriétés physiques et chimiques différentes sont des isomères.
Isomères de constitution
Si leurs formules semi-développées planes sont différentes, ce sont des isomères de constitution. On distingue :
- les isomères de chaîne qui ne diffèrent que par leur chaîne carbonée.
Exemple : $\rm{CH_3-CH_2-CH_2-CH_3}$ et $\rm{CH_3-CH(CH_3)-CH_3}$.
- les isomères de position qui ne diffèrent que par la position de la fonction.
Exemples : $\rm{CH_2=CH-CH_2-CH_3}$ et $\rm{CH_3-CH=CH-CH_3}$ ; $\rm{CH_2(OH)-CH_2-CH_3}$ et $\rm{CH_3-CH(OH)-CH_3}$.
- les isomères de fonction qui ne diffèrent que par leur fonction.
Exemples : $\rm{CH_3-CH_2-CHO}$ et $\rm{CH_3-CO-CH_3}$ ; $\rm{CH_3CH_2OH}$ et $\rm{CH_3-O-CH_3}$.
Stéréoisomères
Si leurs formules semi-développées planes sont identiques, ce sont des stéréoisomères ; leurs différences ne peuvent s'observer que sur des représentations spatiales. On distingue :
- les isomères de conformation ou conformères qui ne diffèrent que par une libre rotation autour d'une liaison simple (formes « bateau » et « chaise » de la molécule du cyclohexane ; les représentations « décalées » et « éclipsée » de Newman de la molécule d'éthane) ;
- les isomères de configuration ou configurations qui ne diffèrent que par la disposition spatiale de deux liaisons. On trouve :
- les configurations $\rm{Z}$ et $\rm{E}$ puis $\rm{cis}$ et $\rm{trans}$ (chez les alcènes) ;
- les énantiomères qui sont images l'un de l'autre dans un miroir, mais ne sont pas superposables. Ils doivent leur existence à la présence d'un atome de carbone asymétrique, noté $\rm{C^*}$ (atome de carbone lié à quatre atomes ou groupes d'atomes tous différents). Une molécule ayant un seul atome de carbone asymétrique est chirale (non superposable à son image dans un miroir) ;
- diastéréoisomères : lorsque les molécules ne sont pas images l'une de l'autre dans un miroir et ne sont pas superposables, elles sont appelées des diastéréoisomères.
N.B. : Un nombre impair de permutations donne l'autre énantiomère alors qu'un nombre pair de permutations donne le même énantiomère.
Une molécule chirale – mélange racémique
Une molécule chirale est optiquement active ou douée de pouvoir rotatoire, c'est-à-dire que lorsqu'une solution la contenant est traversée par une lumière polarisée (les vecteurs lumineux gardent la même direction), celle-ci change de direction. Si la lumière est déviée dans le sens des aiguilles d'une montre alors la molécule est dite dextrogyre ; dans le cas contraire c'est une molécule lévogyre. Les énantiomères sont aussi appelés antipodes optiques.
Une solution contenant en quantités égales des molécules dextrogyres et lévogyres ne dévie pas la lumière polarisée ; elle est optiquement inactive. On l'appelle un mélange racémique.
Représentation de Fischer
À l'exception de la glycine tous les acides-aminés sont chiraux car présentant un carbone asymétrique. Pour dessiner les deux énantiomères on utilise la convention de Fischer :
- le groupe carboxyle ($\rm{-COOH}$) est situé verticalement en haut et en arrière du plan de la figure,
- le résidu (R-) est situé verticalement en bas et en arrière du même plan,
- les liaisons $\rm{C-H}$ et $\rm{C-NH_2}$ pointent horizontalement vers l'avant (« ils nous tendent les bras »).
Ensuite on projette la molécule dans le plan vertical pour obtenir la représentation de Fischer (pour alléger on ne représente pas l'atome de carbone fonctionnel).

Dans la représentation de Fischer si le groupe amino ($\rm{-NH_2}$) est à droite, on a l'énantiomère $\rm{D}$, s'il est à gauche il s'agit de l'énantiomère $\rm{L}$.
Remarque : $\rm{D}$ et $\rm{L}$ ne veulent pas dire respectivement dextrogyre et lévogyre.
Propriétés chimiques
Caractère ampholyte
En solution aqueuse un acide $\alpha$-aminé se trouve sous la forme de l'ion dipolaire appelé amphion ou zwittérion qui est un ampholyte.

Caractère acido-basique de l'Amphion
- Caractère basique : $\rm{H_3N^+ –CH(R)−CO_2 + H_2O \longrightarrow H_3N^+ -CH(R)−CO_2H + OH^-}$
Donc on a le couple $\rm{H_3N^+ –CH(R)−CO_2H / H_3N^+ –CH(R)-CO_2 \longrightarrow cation / amphion}$ ou $\rm{Z^+/Z}$ de $\rm{pKa = pKa1}$
- Caractère acide : $\rm{H_3N^+ –CH(R)−CO_2 + H_2O \longrightarrow H_2N-CH(R)−CO_2 + H_2O}$
Donc on a le couple $\rm{H_3N^+ –CH(R)−CO_2 / H_2N-CH(R)-CO_2 \longrightarrow amphion/anion}$ ou $\rm{Z/Z^-}$ de $\rm{pKa = pKa2}$
Domaine de prédominance

Point isoélectrique ou isoionique $\rm{pH_i}$
$\displaystyle \rm{pH_i = \frac{1}{2} (pKa_1 + pKa_2)}$
Synthèse des polypeptides
Ayant une fonction amine (base) et une fonction acide carboxylique (acide), deux molécules d'acides $\alpha$-aminés peuvent réagir entre elles en éliminant une molécule d'eau (réaction de condensation). On obtient ainsi un dipeptide.
![]()
Ce dernier peut à son tour réagir avec l'un d'entre eux pour donner un tripeptide. Ainsi de suite on aboutit à un polypeptide caractérisé par la présence de plusieurs liaisons peptidiques –CO-NH-.
![]()
Remarque : lors de la formation d'un dipeptide, l'acide $\alpha$-aminé dont le groupe amino ($\rm{-NH_2}$) n'a pas réagit est l'acide $\alpha$-aminé $\rm{N}$-terminal alors que celui dont le groupe carboxyle ($\rm{-COOH}$) n'a pas réagi est l'acide $\alpha$–aminé $\rm{C}$-terminal.
Synthèse sélective
Pour avoir le dipeptide souhaité, on fait une synthèse sélective en bloquant une fonction et en activant l'autre sur la même molécule.
- Pour bloquer, la fonction acide carboxylique est transformée en une fonction ester et la fonction amine est transformée en amide.
- Pour activer la fonction acide carboxylique, on la transforme en une de ses fonctions dérivées telles que l'anhydride d'acide ou le chlorure d'acyle.
Nomenclature
Un polypeptide est désigné en nommant successivement tous les acides $\alpha$-aminés qui le constituent, en commençant par l'acide $\alpha$-aminé $\rm{N}$-terminal et en terminant par l'acide $\alpha$-aminé $\rm{C}$-terminal.
Exemples :