1. Acide fort
Un acide fort est une espèce chimique qui s'ionise totalement dans l'eau pour donner l'ion hydronium $\rm{H3O}^+$. Une mole d'un polyacide s'ionise totalement dans l'eau pour donner plusieurs moles d'ions $\rm{H3O}^+$.
Pour une solution aqueuse d'acide fort pas très concentrée $(\rm{C} < 10^{-1} ~\rm{mol.L}^{-1})$ et pas très diluée $(\rm{C} > 10^{-6,5} ~\rm{mol.L}^{-1}=3,16.10^{-7} ~\rm{mol.L}^{-1})$, le $\rm pH$ est donné par la relation $\rm{pH}=-\log \rm{C}$.
$\rm{C}$ étant la concentration de l'acide, car $[\rm{H_3O}^+]=\rm{C}$.
Pour un polyacide fort, $[\rm{H_3O}^+]=n \rm{C}$, $\rm{pH}=-\log n \rm{C}$ où $n$ est le nombre de moles de $\rm{H_3O}^+$ données par une mole du polyacide.
2. Base forte
Une base forte est une espèce chimique qui est totalement ionisée dans l'eau pour donner l'ion hydroxyde $\rm{OH}^-$.
Une mole de polybase libère plusieurs moles de $\rm{OH}^-$.
Une base forte peut réagir totalement avec l'eau pour donner des ions hydroxydes.
Pour des solutions aqueuses basiques pas très concentrées $(\rm{C}< 10^{-1} \rm{mol.L}^{-1})$ et pas très diluées $(\rm{C} > 3,16.10^{-7}~\rm{mol.L}^{-1})$, on a $\rm{pH}=\rm{pKe} + \log \rm{C}$. À 25°\rm{C} $\rm{pH}=14 + \log \rm{C}$.
Pour une polybase $\rm{pH}= \rm{pKe}+\log n\rm{C}$ et à $25°\rm{C}$ $\boxed{\rm{pH}=14+\log n\rm{C}}$.
3. Dosages acide fort-base forte
Doser (ou titrer) une espèce chimique, c'est déterminer la quantité de matière de cette espèce présente dans un échantillon. Pour doser l'espèce, on la fait réagir avec un corps par une réaction qui doit être :
- À l'équivalence acido-basique on a : $n_{\rm{H3O}^+}=n_{\rm{OH}^-}$.
Exemples : dosage de l'acide chlorhydrique (monoacide) par l'hydroxyde de sodium (monobase) et vice versa $\rm{C}_{\rm{A}}\rm{V}_{\rm{A}}=\rm{C}_{\rm{B}}\rm{V}_{\rm{B}}$ ; dosage de l'acide sulfurique (diacide) par l'hydroxyde de potassium et inversement : $2\rm{C}_{\rm{A}}\rm{V}_{\rm{A}}=\rm{C}_{\rm{B}}\rm{V}_{\rm{B}}$.
- Expérimentalement l'équivalence acido-basique est déterminée par :
- le virage de l'indicateur coloré adapté lors d'un dosage colorimétrique (utilisation d'indicateur coloré), le volume versé à l'équivalence et la relation d'équivalence permettent de déterminer l'inconnu ;
- le saut du pH lors d'un dosage pH-métrique (utilisation d'un pH-mètre). L'abscisse du point équivalent E permet de déterminer le volume versé à l'équivalence \rm{V}_{\rm{E}} et par la suite l'inconnu.
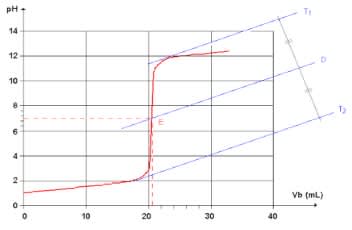
4. Étude de la courbe de dosage pH-métrique
Dosage d'un acide fort par une base forte :
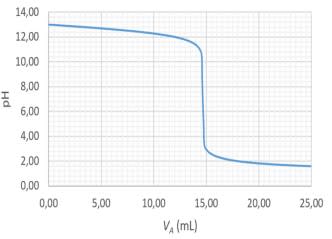
Dosage d'une base forte par un acide fort :
Exploitation de la courbe : Pour faciliter la leçon on utilisera la première courbe.
Celle-ci comporte trois parties :
- Un premier palier $(\rm{V}_{\rm{B}}<\rm{V}_{\rm{E}})$ presque horizontal correspondant à un milieu nettement acide.
- Une brusque variation du $\rm pH$, qui passe d'un $\rm pH$ acide à un $\rm pH$ basique. La courbe présente un point d'inflexion $\rm E$ correspondant à un maximum très pointu :
- les coordonnées de ce point $\rm E$ {$\rm{pH}=\rm{PHéq}$ (ici $\rm{pHéq}=7$) ; $\rm{V}_{\rm{B}}=\rm{V}_{\rm{E}}$ } sont données par la méthode des tangentes.
- Un deuxième palier $(\rm{V}_{\rm{B}} > \rm{V}_{\rm{E}})$ presque horizontal correspondant à un milieu nettement basique.


