I. Notion de mélange
Définition
Un mélange est un ensemble de deux ou plusieurs substances.
Les types de mélanges
On distingue deux types de mélanges : le mélange homogène et le mélange hétérogène.
- Mélange homogène : Un mélange homogène est un mélange dans lequel on ne peut pas distinguer à l’œil nu ses différents constituants. Un tel mélange présente une seule phase.
Exemples : eau + sel ; l’air ; eau + alcool ; eau + sucre… - Mélange hétérogène : Un mélange est hétérogène lorsque, à l’œil nu, on peut distinguer ses différents constituants. Exemples : sable + sucre ; huile + eau ; eau + sable…
II. Les méthodes de séparation d’un mélange
La décantation
La décantation est un procédé qui consiste à laisser reposer un liquide trouble afin que les particules solides lourdes se déposent au fond puis à faire un transvasement lent.
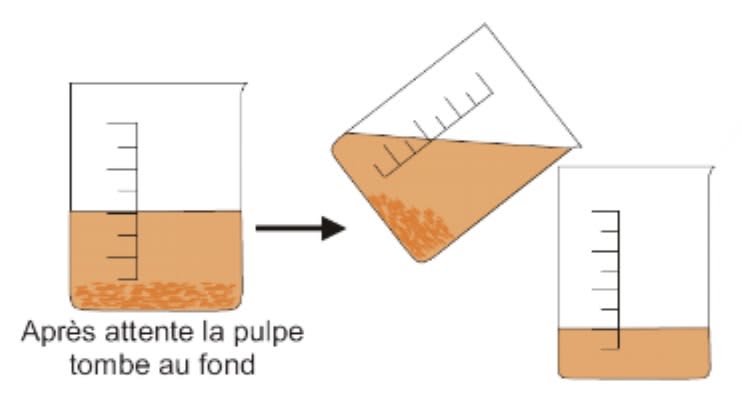
Exemple : Décantation d'un jus d'orange avec pulpe
Remarque : L’eau décantée est un mélange hétérogène non pur car elle contient des particules légères.
La filtration
C’est l’opération qui consiste à laisser passer un liquide à travers un filtre afin de retenir les particules.
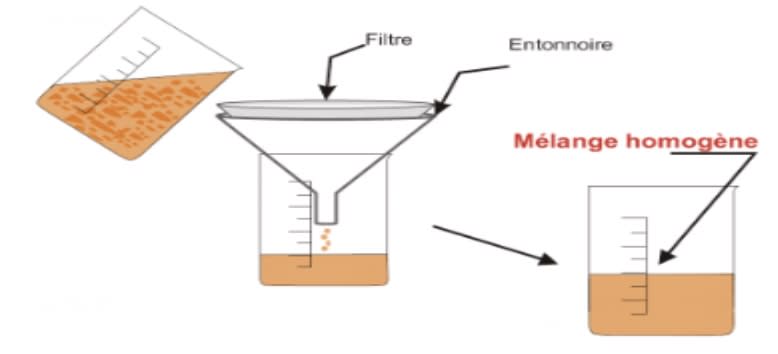 Exemple : Filtration d'un jus d'orange pour enlever la pulpe
Exemple : Filtration d'un jus d'orange pour enlever la pulpe
Remarque : Le filtrat est un mélange homogène non pur, car elle contient des particules finement divisées.
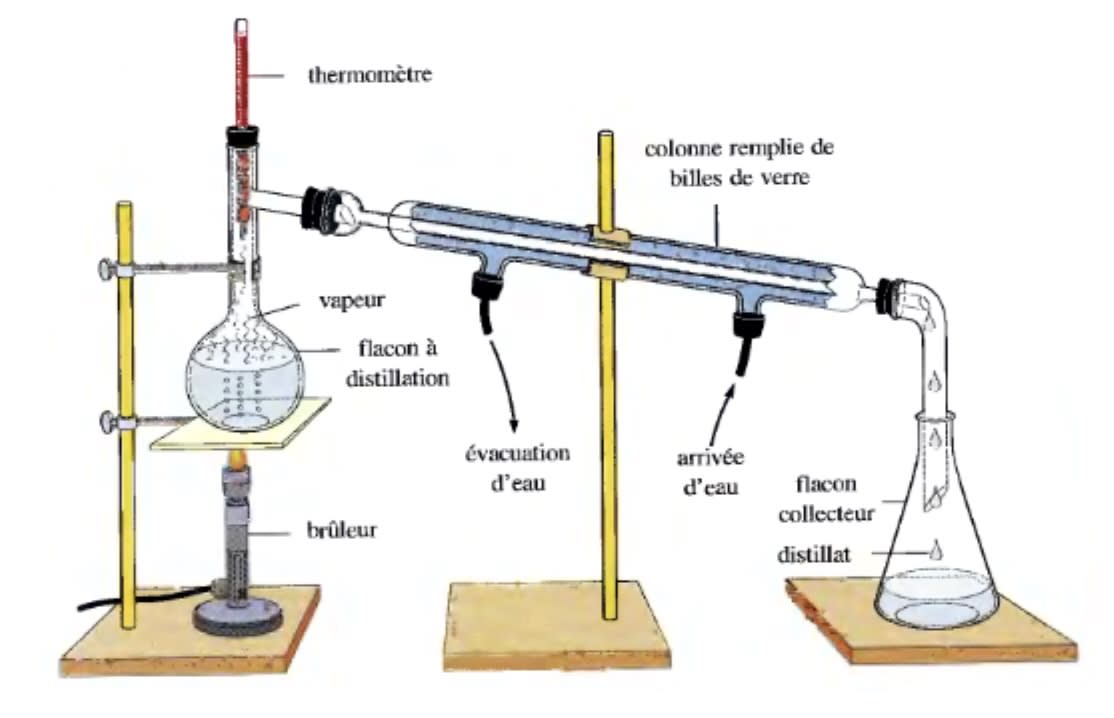
La distillation
Elle consiste à chauffer le mélange homogène jusqu’à l’ébullition dans un ballon. La vapeur obtenue est conduite dans un réfrigérant (refroidie par un courant d’eau) où elle se liquéfie. Le liquide recueilli à la sortie du réfrigérant est appelé distillat ou liquide distillé.
Autres méthodes de séparation
Il existe d’autres méthodes de séparation parmi lesquelles on peut citer :
- Pour les mélanges solide-solide, on a : le triage, le vannage, la ventilation, le tamisage, le criblage, la centrifugation, etc.
- Pour les liquides : distillation fractionnée, congélation fractionnée, etc.
III. Corps purs
Définition
Un corps est dit pur si, lorsqu’on le soumet à diverses méthodes de séparation, il ne donne pas d’autres corps purs. C'est-à-dire que toutes les parties d’un corps pur sont identiques.
Exemple : lorsqu’on distille de l’eau distillée, on obtient toujours de l’eau distillée. De même, qu’on la filtre ou qu’on la décante, on a toujours de l’eau distillée. L’eau distillée est alors un corps pur, appelé eau pure.
Les constantes physiques
Un corps pur est caractérisé par ces critères de pureté qui sont des constantes physiques telles que la température de fusion ; la température d’ébullition ; la masse volumique, etc.
IV. Analyse et synthèse de l’eau
Analyse de l’eau
- Dispositif expérimental
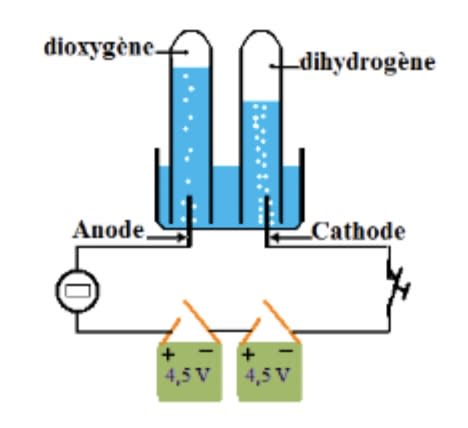
Versons de l’eau additionnée de soude dans la cuve de l’électrolyseur puis fermons l’interrupteur. - Observations
On constate que la lampe s’allume et un dégagement de bulles de gaz au niveau des électrodes : ces bulles de gaz montent dans les tubes.
Identification des gaz
Le gaz qui se dégage à l’électrode reliée à la borne négative (cathode) détonne en présence d’une flamme : c’est du dihydrogène.
Le gaz qui se dégage à l’électrode reliée à la borne positive (anode) rallume un brin incandescent : c’est du dioxygène.
Le volume de dihydrogène est le double de celui de dioxygène : $\rm V_{H_2}=2V_{O_2}$
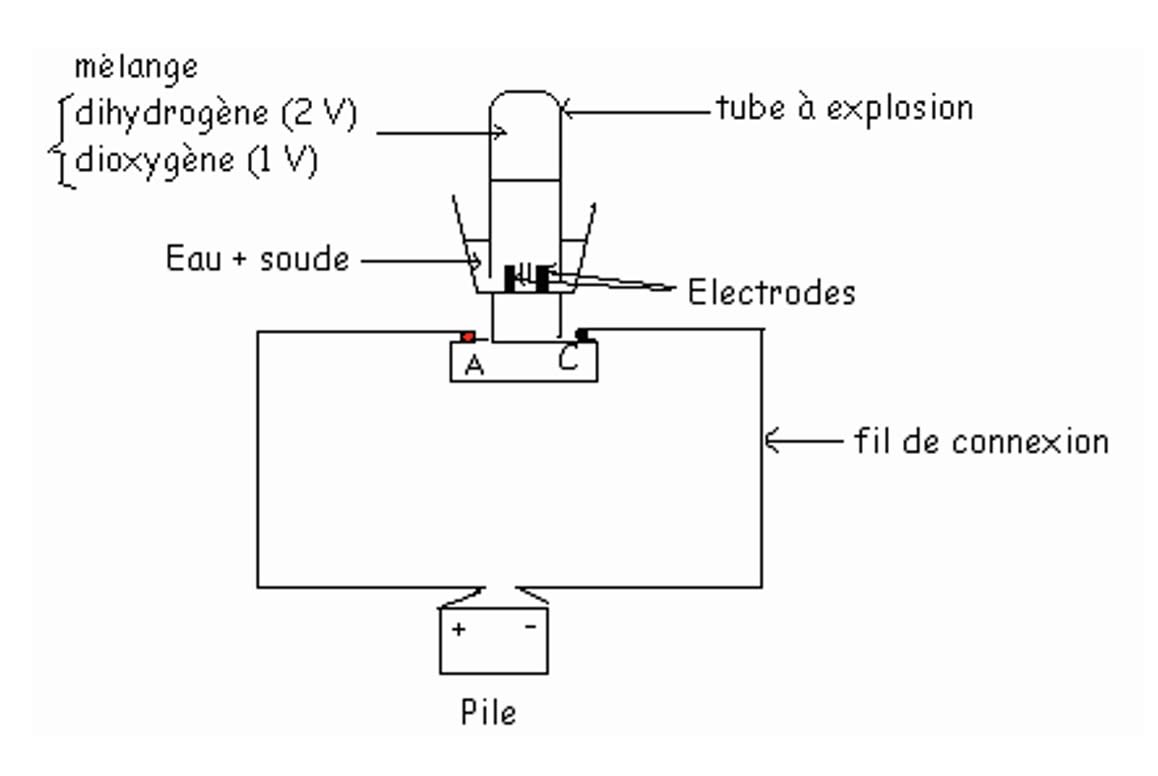
- Conclusion
L’électrolyse de l’eau (décomposition de l’eau) fournit deux gaz : le dioxygène et le dihydrogène.
Synthèse de l’eau
- Dispositif expérimental
Mélangeons dans un eudiomètre du dihydrogène et du dioxygène tel que $\rm V_{H_2}$ soit le double de $\rm V_{O_2}$ puis faisons passer une étincelle électrique. - Observations
On constate une petite explosion suivie de la formation de gouttelettes d’eau sur les parois internes du tube. - Conclusion
Le dihydrogène et le dioxygène se combinent pour donner de l’eau.
IV. Corps purs simple et corps purs composé
Corps purs composés
Par décomposition, l’eau peut donner le dihydrogène et le dioxygène : l’eau est un corps pur composé
Définition : Un corps est dit pur composé s’il peut donner d’autres corps purs par décomposition.
Corps purs simples
Le dihydrogène et le dioxygène n’ont jamais pu être décomposés en d’autres corps purs : on les appelle des corps purs simples.
Définition : Un corps est dit pur simple s’il ne peut pas se décomposer en d’autres corps purs.
V. Autre exemple de mélange : l’air.
L’analyse quantitative de l'air montre qu’il est constitué de diazote (78 %), de dioxygène (21 %) et des constituants minoritaires : 1 % en volume de vapeur d’eau, dioxyde de carbone ou gaz carbonique et gaz rares (argon, hélium, néon, krypton…).
Approximativement l’air contient donc en volume 1/5 de dioxygène et 4/5 de diazote.


