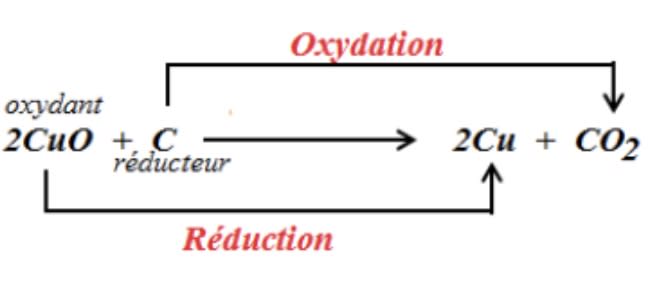
I. Action du carbone sur l’oxyde de cuivre II.
La réaction entre l’oxyde de cuivre II et le carbone est une réaction chimique.
Elle se traduit par cette équation bilan :
2CuO+C →2Cu+CO2
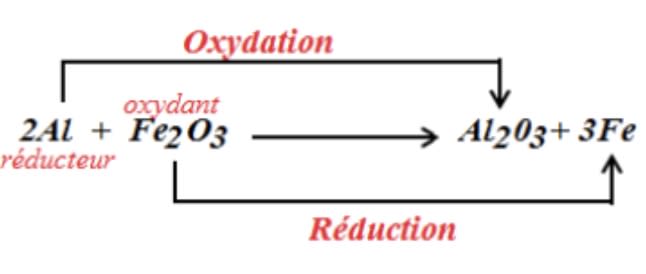
Action de l’aluminium sur l’oxyde ferrique
Au cours de cette réaction, on assiste aussi à la réduction de l’oxyde de fer par l’aluminium et à l’oxydation de l’aluminium par l’oxyde de fer : c’est aussi une réaction d’oxydoréduction.
L’équation bilan de cette réaction chimique est :
$\mathrm{Fe}_2 \mathrm{O}_3+2 \mathrm{Al} \rightarrow 2 \mathrm{Fe}+\mathrm{Al}_2 \mathrm{O}_3$
II. Interprétation des réactions chimiques
1. Réaction entre l’oxyde de cuivre II et le carbone
- Le carbone (C) gagne des atomes d’oxygène pour former le dioxyde de carbone (CO2). On dit que le carbone a été oxydé par l’oxyde de cuivre II : le carbone est le réducteur.
- L’oxyde de cuivre II cède ses atomes d’oxygène au carbone pour devenir le cuivre métal (Cu). On dit le carbone a réduit l’oxyde de cuivre II : L’oxyde de cuivre II est l’oxydant.
2. Réaction entre l’oxyde de fer par l’aluminium
Fe2O3+2Al→2Fe+Al2O3
- L’oxyde de fer (Fe2O3) cède ses atomes d’oxygène au métal aluminium (Al). L’aluminium a été oxydé par l’oxyde de fer : L’oxyde de fer est l’oxydant.
- L’aluminium gagne des atomes d’oxygène pour former l’alumine (Al2O3). On dit que l’oxyde de fer a été réduit par l’aluminium : l’aluminium est le réducteur.