Électrolyse de l’eau
1. Définition
Analyser un corps revient à chercher ses constituants par une méthode appropriée. L’appareil utilisé pour réaliser l’analyse de l’eau est appelé électrolyseur.
2. Dispositif expérimental
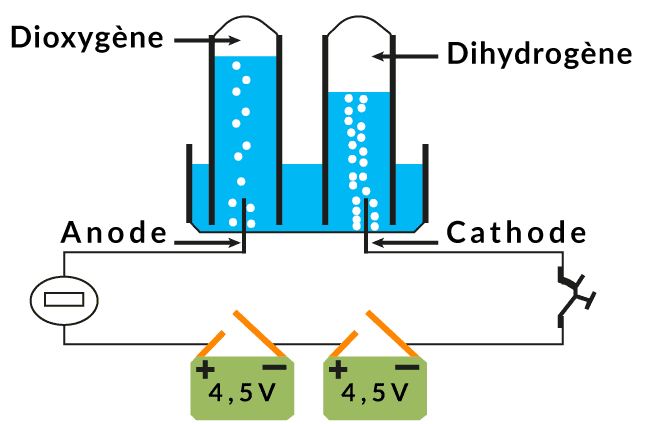
Versons de l’eau additionnée de soude dans la cuve de l’électrolyseur puis fermons l’interrupteur.
3. Observations
On constate que la lampe s’allume et qu'il y a un dégagement de bulles de gaz au niveau des électrodes : ces bulles de gaz montent dans les tubes.
4. Identification des gaz
- Le gaz qui se dégage à l’électrode reliée à la borne négative (cathode) produit une faible détonation ou explosion en présence d’une flamme : c’est du dihydrogène.
- Le gaz qui se dégage à l’électrode reliée à la borne positive (anode) rallume une bûchette en incandescence : c’est du dioxygène.
- Le volume de dihydrogène est le double de celui de dioxygène : $V\left(H_2\right)=2 V\left(O_2\right)$
5. Conclusion
La décomposition de l’eau ou l’électrolyse de l’eau est une réaction chimique qui produit le dihydrogène $\rm (H_2)$ et le dioxygène $\rm (O_2)$. Son équation-bilan est : $2 \mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{H}_2+\mathrm{O}_2$